
María Josefina Sobrero ID· María Josefina Etchevers ID
Servicio de Gastroenterología Hospital Italiano de Buenos
Aires.
Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2022;52(3):306-321
Recibido: 21/08/2022 / Aceptado:
22/09/2022 / Publicado online el 29/09/2022 / https://doi.org/10.52787/agl.v52i3.242
Las enfermedades inflamatorias intestinales son entidades crónicas con manifestaciones y evolución heterogéneas, por lo que constituyen un desafío diagnóstico y terapéutico. En los últimos años se han producido cambios trascendentales en el manejo de las enfermedades inflamatorias intestinales, de la mano del mayor conocimiento de su inmunofisiopatología y evolución a largo plazo. A diferencia de otras enfermedades, la clínica no es soberana y debemos respaldarnos en parámetros más certeros de inflamación para la toma de decisiones. Con el advenimiento de nuevas herramientas bioquímicas, de imágenes y endoscópicas, el enfoque actual está dirigido a lograr un menor retraso en el diagnóstico y un monitoreo estrecho de la curación mucosa como una de las metas fundamentales asociada a una evolución favorable. El objetivo de esta revisión es actualizar los nuevos conceptos respecto a estrategias diagnósticas y de monitoreo en las enfermedades inflamatorias intestinales.
Palabras claves. Enfermedad Inflamatoria Intestinal, enfermedad de Crohn, colitis ulcerosa, biomarcadores, estudios por imágenes, colonoscopía, diagnóstico diferencial, curación mucosa.
Inflammatory bowel diseases are chronic entities with heterogeneous manifestations and evolution, which is why they constitute a diagnostic and therapeutic challenge. In recent years, there have been transcendental changes in the management of inflammatory bowel diseases, with a better knowledge of its immunophysiopathology and long-term evolution. Unlike other diseases, the clinical manifestations are not always the most important, and we must rely on more accurate parameters of inflammation for decision making. With the advent of new biochemical, imaging and endoscopic tools, the current approach is intended to achieve less delay in diagnosis and close monitoring of mucosal healing as one of the fundamental goals associated with a favorable outcome. The objective of this review is to update the new concepts regarding diagnostic and monitoring strategies in inflammatory bowel diseases.
Keywords. Inflammatory bowel disease, Crohn's disease, ulcerative colitis, biomarkers, imaging studies, colonoscopy, differential diagnosis, mucosal healing.
Abreviaturas
AGA: American Gastroenterological Association.
ASGE:
American Society for Gastrotinestinal Endoscopy.
ANCA-p:
Anticuerpo anticitoplasma neutrofilico perinuclear.
Anti-CBir 1:
Anticuerpo anti-antígeno tipo flagelina.
Anti-OmpC: Anticuerpo anti-porina C de
la membrana externa de Escherichia coli.
Anti-I2: Anticuerpo anti Pseudomonas
fluorescens.
ASCA: Anticuerpo anti Sacharomises
cervisiae.
CF: Calprotectina en materia
fecal.
CDAI: Crohn’s Disease Activity Index.
CEP:
Colangitis Esclerosante Primaria.
CM: Curación
Mucosa.
CMV: Citomegalovirus.
CU: Colitis
Ulcerosa.
ECCO: European Crohn´s and Colitis
Organisation.
EII: Enfermedades Inflamatorias Intestinales.
EIINC: Enfermedad Inflamatoria Intestinal No
Clasificable.
EC: Enfermedad de
Crohn.
ESD: Eritrosedimentación.
e-TC:
Enterotomografía.
e-RMN: Enteroresonancia.
ID:
Intestino Delgado.
IGRA: Prueba de liberación de
interferón-gamma.
MEI: Manifestaciones Extra
Intestinales.
PCR: Proteína C reactiva MaRIA: Magnetic Resonance Index of
Activity.
TBC: Tuberculosis.
Las enfermedades inflamatorias intestinales (EII) son enfermedades crónicas de carácter inmune que presentan inflamación de la mucosa gastrointestinal y se manifiestan con episodios de actividad que pueden alternar con períodos de remisión. Las dos entidades principales son la colitis ulcerosa (CU), caracterizada por la inflamación mucosa del colon que se inicia en forma continua ascendente desde el recto, con extensión variable, y la enfermedad de Crohn (EC), de afectación transmural y con frecuencia segmentaria, pudiendo involucrar desde la boca hasta el ano. Del 10 al 15% de los casos tienen características de ambas, sin encuadrarse en ninguna de las enfermedades descriptas previamente; se las denomina enfermedades inflamatorias intestinales no clasificables (EIINC).1
Los síntomas típicos de las EII son el dolor abdominal, la diarrea y el sangrado rectal, pero al ser enfermedades heterogéneas, según el sector involucrado y el fenotipo individual de cada paciente, pueden presentarse con otros síntomas como náuseas, vómitos, fiebre, pérdida de peso o retraso en el crecimiento.2 Alrededor del 50% de nuestros pacientes presentan manifestaciones extraintestinales asociadas (MEI), que incluyen, entre las más frecuentes, artropatía periférica o axial, uveítis, lesiones en piel y aftas orales.3
Las EII constituyen un desafío diagnóstico debido a los múltiples síntomas que pueden presentarse y la diversidad de posibles diagnósticos diferenciales. Al día de la fecha no existe un método de evaluación considerado gold standard. El diagnóstico definitivo se alcanza como resultado de la conjunción de características clínicas, bioquímicas, radiológicas, endoscópicas e histopatológicas (Figura 1).
Figura 1. Herramientas diagnósticas en EII. Lo que va a llevar al
diagnóstico de certeza es la combinación de parámetros clínicos, bioquímicos, radiológicos, endoscópicos
e histológicos
Una vez establecido el diagnóstico debemos utilizar herramientas objetivas para determinar el riesgo de complicaciones en la evolución de cada paciente, definiendo en base a ello el tratamiento necesario. Al establecer el tratamiento se debe acordar con el paciente cómo realizar el monitoreo para lograr los objetivos planteados, vinculados a evitar complicaciones y lograr una adecuada calidad de vida (“tratamiento por objetivos”).4, 5
El objetivo de esta revisión es presentar una actualización de las herramientas disponibles para un manejo óptimo del paciente con EII, desde el diagnóstico, la estadificación del riesgo, el monitoreo del tratamiento y la evolución de la enfermedad.
Colitis Ulcerosa
Debido a que la enfermedad está limitada al colon, los síntomas son menos heterogéneos; sin embargo, según la extensión involucrada, se puede presentar un amplio espectro de manifestaciones.6 El tiempo transcurrido entre la aparición de la clínica y el diagnóstico suele ser de semanas o meses, más breve que en la EC, en la que puede demorar años.
La principal característica de la CU es la diarrea por tránsito rápido del contenido intestinal a través del colon inflamado. A menudo es postprandial y también puede ser nocturna. La gravedad de la diarrea está relacionada con la extensión de la inflamación. La inflamación limitada al recto lleva a evacuaciones intestinales frecuentes y de pequeño volumen, y se asocia con el paso frecuente de moco; los pacientes pueden referir constipación, con dificultad en evacuar materia fecal, presentando exclusivamente mucorrea con sangre. A medida que la afectación es más extensa la diarrea va siendo más líquida, de mayor volumen y gravedad. El sangrado se presenta en la mayoría de los pacientes y la severidad aumenta con la extensión y la profundidad de las úlceras (Figura 2). Se observa sangrado severo hasta en el 10% de los casos, y en 1 a 3% hemorragia masiva que puede requerir una intervención quirúrgica. La colitis fulminante o megacolon tóxico se observa en el 15% de los pacientes con CU y puede provocar un sangrado severo o perforación colónica que llega a requerir cirugía de urgencia.7
Figura 2. Características clínicas de la CU según la extensión
colónica afectada
El dolor abdominal suele ser cólico, pre-evacuatorio o manifestarse como tenesmo rectal. En caso de CU extensas de larga evolución que desarrollan estenosis pueden aparecer síntomas oclusivos; en esos casos siempre, en primer término, debe descartarse malignidad asociada.
Enfermedad de Crohn
Dado que la EC puede involucrar cualquier sector del tracto gastrointestinal, la gravedad y la ubicación de la enfermedad dictan los signos y síntomas asociados, lo que conduce a un amplio espectro de presentaciones clínicas. Las características clásicas de la EC incluyen dolor abdominal, diarrea acuosa y pérdida de peso. El dolor abdominal suele ser cólico y a menudo persiste durante muchos años antes del diagnóstico.8 Debido a la predilección de afectación del íleon terminal, el dolor suele localizarse en el cuadrante inferior derecho, por lo que los pacientes suelen tener varias consultas a Emergencias y el diagnóstico se confunde con apendicitis aguda.9
La diarrea es más importante en caso de compromiso colónico y si bien el sangrado es menos frecuente (1-2%) cuando ocurre suele ser muy severo dada la transmuralidad de las úlceras. La disminución de peso es multifactorial, debido a la diarrea, malabsorción, anorexia y temor a ingerir alimentos debido al dolor.10
Las fístulas intestinales ocurren en un 20% a 40% de los pacientes. Pueden formarse con cualquier estructura adyacente: intestino, vejiga, piel o vagina. Las fístulas enteroentéricas son la forma más común de EC fistulizante. Estas fístulas pueden ser clínicamente asintomáticas y contribuyen a la malabsorción y la diarrea. Las fístulas enterovaginales les siguen en frecuencia y se manifiestan con el paso de materia fecal o gases a través de la vagina. Las fístulas enterocutáneas provocan el drenaje de contenido entérico a través de la piel. Las fístulas enterovesicales representan el 3% de todas las fístulas. Los tractos sinusales no siempre conducen a fístulas, pero también pueden resultar en el desarrollo de abscesos intraabdominales o flemones.11, 12
En el fenotipo estenosante se observan estrecheces que pueden ocasionar obstrucción, con dolor abdominal, náuseas, y vómitos. La presentación puede ser aguda o insidiosa. Las estenosis se producen a lo largo del tracto GI, siendo más frecuentes las de intestino delgado, pero también se observan obstrucción de salida, obstrucción colónica y estenosis anal.
Hasta un tercio de los pacientes con EC tienen compromiso perianal (EPA). Las manifestaciones más comunes incluyen fístulas, fisuras, abscesos y papilomas cutáneos. Este fenotipo suele ser una forma más agresiva de la enfermedad y puede requerir diferentes intervenciones médicas y quirúrgicas. La incidencia de fístulas perianales se asocia más con la colitis de Crohn con afectación rectal. Aproximadamente el 15% de los pacientes tienen fístula perianal en el momento de su diagnóstico. La incidencia global de fístulas perianales oscila entre el 17% y el 43%.13, 14
En la Tabla 1 se describe la Clasificación de Montreal, diseñada por los referentes internacionales en EII, desarrollada en el contexto del Congreso Mundial de Gastroenterología del año 2005 con el fin de pautar y homogeneizar definiciones de fenotipo y comportamiento, tanto para EC como CU.15
Tabla 1. Clasificación de las EII (Montreal 2005)
Manifestaciones extraintestinales (MEI)
Hasta la mitad de los pacientes con EII, más frecuentemente en la EC de compromiso colónico, presentan al menos una MEI, que puede preceder al diagnóstico de la EII. El riesgo de desarrollar una MEI aumenta con el tiempo de duración de la EII y con la presencia de una MEI previa. En estos casos es imprescindible el manejo interdisciplinario, ya que el compromiso extraintestinal puede impactar gravemente en la calidad de vida o, en algunos casos, en la expectativa de vida, como ocurre con la colangitis esclerosante primaria (CEP) o los eventos tromboembólicos. Las MEI suelen tener un curso paralelo al de la EII, a excepción de la espondilitis anquilosante, la uveítis, la CEP y el pioderma gangrenoso (Tabla 2).3,16
Tabla 2. Manifestaciones extra-intestinales (MEIs) asociadas a la
EII
En EII, la clínica no es soberana y tiene baja seguridad para predecir la presencia de enfermedad activa objetiva, tanto en la CU como en la EC. En el caso de la CU se ha descrito que hasta un 20% de pacientes con sangrado rectal pueden tener CM y, a la inversa, el 50% de los pacientes con actividad endoscópica moderada a severa no tienen sangrado.17 En EC esto es más notorio, ya que casi la mitad de los pacientes en remisión clínica prolongada presentan úlceras en la endoscopía y hasta un 18% de los pacientes con índices clínicos de severidad (CDAI > 220) no tienen lesiones en la endoscopía.18 Conociendo la importancia de la CM como predictor de evolución, debemos utilizar parámetros bioquímicos, endoscópicos y de imágenes objetivos para predecir la actividad y severidad de la EII.
Biomarcadores
Los biomarcadores tienen la particularidad de medir objetivamente y evaluar procesos biológicos normales, procesos patológicos o respuestas farmacológicas a una intervención terapéutica. El biomarcador ideal debería contar con ciertas características como ser no invasivo, aceptable por el paciente, accesible, económico, específico, reproducible, seguro, preciso, estandarizado, con umbrales definidos (positivo/negativo, leve/moderado/severo), rangos dinámicos (que permitan definir distintos grados de inflamación), rápidos de obtener y con resultados sensibles al cambio en el estado inflamatorio. En EII hay descritos numerosos biomarcadores en sangre y materia fecal que apoyan el diagnóstico de EII ante la sospecha clínica y endoscópica (Tabla 3), pero al ser inespecíficos su mayor utilidad consiste en diferenciar enfermedad orgánica versus funcional, estimar el grado de inflamación en forma no invasiva, predecir el riesgo de complicaciones y monitorizar la respuesta a los tratamientos.19, 20 En esta revisión nos referiremos específicamente a los más utilizados en la actualidad.
Tabla 3. Biomarcadores actuales en el monitoreo de la EII
Proteína C Reactiva (PCR) y Eritrosedimentación (ESD)
Tanto la PCR como la ESD son marcadores reactantes de fase aguda producidos en respuesta a las citoquinas inflamatorias. Entre ambas se aconseja la medición de la PCR, ya que la ESD se eleva más tardíamente, no es útil en la colitis distal y no tiene valor pronóstico. La PCR tiene una vida media más corta (19 horas).21 En la EC se ha demostrado la correlación entre los niveles elevados de PCR con la actividad clínica, endoscópica e histológica, así como un mayor riesgo de hospitalización; sin embargo, hasta un 30% de pacientes con actividad endoscópica no elevan el valor de la PCR, con lo cual su fortaleza es su valor predictivo negativo.22 En la CU la PCR adquiere gran relevancia como predictor en brotes graves que requieren hospitalización: la falta de descenso de la misma al tercer día de tratamiento esteroideo endovenoso es pronóstico de alto riesgo de colectomía en más del 70% de los casos.23-25 Al tener una vida media corta tiene la ventaja de disminuir rápidamente cuando hay buena respuesta a los tratamientos instaurados.
Calprotectina en materia fecal (CF)
La CF es quizás el marcador fecal más estudiado y con mayor consistencia a la fecha de su potencial rol en el manejo de la EII. Es una proteína mayor fijadora de calcio y zinc, que se encuentra en el citoplasma de las células inflamatorias y es un marcador directo de la inflamación intestinal. Es una proteína estable con valores constantes durante 4 a 7 días a temperatura ambiente.26 Existen un número importante de condiciones que pueden aumentar su valor, (Tabla 4) por lo que su mayor utilidad se presenta en el algoritmo diagnóstico inicial de aquellos pacientes con sospecha de EII (por clínica, antecedentes familiares, MEI asociadas) y no para el screening en la población general asintomática.27, 28 Si bien se han descrito distintos puntos de corte, se considera que los niveles de CF inferiores a 50-100 µg/g probablemente representen un síndrome de intestino irritable asociado o una enfermedad inactiva, niveles superiores a 250 µg/g sugieren inflamación, y niveles intermedios de 100-250 µg/g son indeterminados y requieren a repetir el dosaje.29
Tabla 4. Condiciones no EII asociadas a Calprotectina Fecal (CF) elevada26

En la EC, los valores de CF se correlacionan con la actividad clínica y endoscópica y la predicción de recaída; en la CU se ha descrito también la correlación con la curación histológica.30, 31, 32 En términos generales se pueden considerar valores menores de 150 µg/ml como predictores de curación endoscópica (e histológica en CU) y valores mayores de 250 µg/ml como predictores fuertes de recaída. Jukic y col.29 proponen algoritmos muy útiles respecto al uso e interpretación de la CF tanto en pacientes con sospecha de EII como en caso de EII confirmada (Figura 3).
Figura 3. Algoritmos propuestos para el manejo de la EII en base a
la CF (28), según sea en el contexto de sospecha de EII (A) o en EII confirmada (B)
A pesar de sus beneficios, la CF fecal no puede considerarse una alternativa absoluta para reemplazar la colonoscopia con el fin de evaluar la actividad endoscópica de la EII. Sin embargo, bajo algunas condiciones, como el embarazo y la pandemia de COVID-19, o como monitoreo intermedio con el fin de evitar estudios invasivos frecuentes, es de gran utilidad. Estudios futuros deben centrarse en evaluar también la eficacia de la CF para predecir eventos evolutivos de relevancia, tales como requerimiento de esteroides, hospitalización y cirugía.
Autoanticuerpos en sangre
Incluyen una amplia variedad de autoantígenos microbianos. No está claro su rol en la patogénesis de la EII. Su significado podría estar vinculado a la pérdida de tolerancia inmune a organismos comensales y/o al aumento de la permeabilidad intestinal con exposición a antígenos microbianos. Sus ventajas incluyen que son fáciles de obtener, no son invasivos y permiten una cuantificación objetiva. En otras enfermedades autoinmunes los anticuerpos tienen un valor crucial en el diagnóstico, en EII esto es más discutido ya que la sensibilidad y especificidad son moderadas a bajas. Los más utilizados y disponibles son el ASCA (Anticuerpo anti Sacharomises cervisiae) y el ANCA-p (anticuerpo anticitoplasma neutrofilico perinuclear).33, 34 Varios estudios han analizado la utilidad diagnóstica de estos anticuerpos: respecto al ANCA-p, su positividad se da en 60 a 70% de los casos de CU y en 10% de los casos de EC. El ASCA tiene una especificidad global del 80% para EC con una sensibilidad variable de 30% para EC de colon y 60% para EC de intestino delgado, mientras que se presenta en 10% de CU. Esta sensibilidad subóptima les resta valor para excluir la enfermedad cuando el resultado es negativo. La utilidad más importante se obtiene para el diagnóstico diferencial entre CU y EC en colon, en el cual la combinación de ASCA (+) /ANCA-p (-) tiene un Valor Predictivo Positivo (VPP) de 84% para EC y la combinación ASCA (-) /ANCA-p (+) un VPP de 84% para CU.35, 36 Existen otros anticuerpos relacionados de menor disponibilidad en la práctica clínica, como el anti antígeno tipo flagelina (Anti-CBir 1), el anti Pseudomonas fluorescens (Anti-I2) y el anti porina C de la membrana externa de Escherichia coli (Anti-OmpC).33
En cuanto al valor predictivo de evolución de estos anticuerpos, existen estudios en pediatría que han demostrado que con un nivel mayor de anticuerpos positivos hay mayor probabilidad de tener complicaciones estenosantes o fistulizantes en EC.37 En CU a mayor nivel de ANCA-P (+) se encontró un mayor riesgo de pouchitis tanto aguda como crónica post coloprotectomía con confección de pouch ileoanal.38
Estudios por imágenes
Si bien la enfermedad colónica e ileal pueden detectarse por medio de la ileocolonoscopía, la ausencia del compromiso en estos segmentos no excluye la EC cuando la sospecha es elevada.38 Para la evaluación del intestino delgado (ID) la enterotomografía (e-TC), la enteroresonancia (e-RMN), la ecografía doppler intestinal (ecodoppler) y el ya en desuso tránsito de ID con doble contraste proveen información complementaria tanto en el diagnóstico como en el monitoreo de complicaciones, actividad inflamatoria y respuesta a los tratamientos.39 Si bien no permiten la toma de biopsias, son menos invasivas y mejor toleradas que la ileocolonoscopía, visualizan todo el ID a la vez que evalúan el espesor total de la pared intestinal y pueden detectar complicaciones extraentéricas de suma importancia en EC. En la Tabla 5 se mencionan la ventajas y desventajas de los distintos métodos. El tránsito doble contraste de ID con bario ha dejado de utilizarse ya que es laborioso, emite radiaciones y no permite determinar actividad.
Tabla 5. Métodos por Imágenes en EII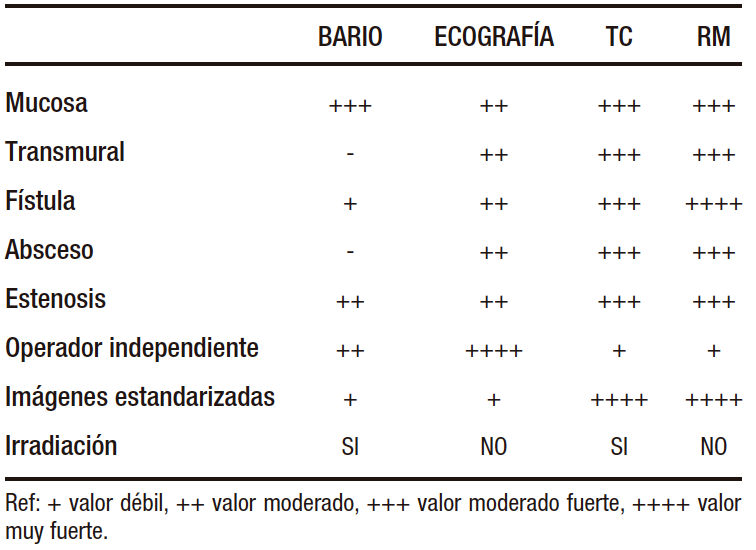
Tanto la e-TC como la e-RMN son modalidades aceptables para diagnosticar inflamación del ID en la EC. Ambas requieren que el paciente se prepare con laxantes previamente y beba un gran volumen de contraste neutro, que se utiliza para distender el intestino y resaltar trastornos intraluminales como inflamación, estenosis y úlceras. También permiten identificar hallazgos extraluminales como fístulas y engrosamiento mesentérico. Hasta el 50% de los casos de EC con colonoscopia normal tienen anormalidades en las imágenes, lo que destaca su utilidad en el diagnóstico de EC.39 Un metaanálisis incluyendo 913 pacientes mostró que la sensibilidad y la especificidad para diagnóstico de EC en ID fueron 87% y 91% respectivamente para la e-TC, y 86% y 93% respectivamente para la e-RMN.40 Al determinar qué modalidad de imagen es mejor para un paciente individual, es importante tener en cuenta las fortalezas y debilidades de cada una.
Debido a que la radiación acumulada resultante de exposiciones repetidas puede entrañar un mayor riesgo de cáncer,41 se sugiere preferir la RMN si está disponible, sobre todo teniendo presente que los pacientes con EII suelen ser jóvenes con requerimiento de varios estudios a lo largo de su vida. El uso actual de la TC está vinculado principalmente a situaciones de urgencia, ya que es un método rápido cuyo uso se sugiere ante la sospecha de complicaciones, punción guiada de colecciones o cirugía urgente altamente probable a la brevedad. La e-RMN es el método actual de elección por lo antes mencionado, sin embargo el paciente debe estar alertado de que el estudio dura más de 1 hora y requiere que el paciente permanezca quieto en un lugar muy cerrado, lo cual es muy difícil de lograr en algunos casos. La e-RMN tiene la ventaja asociada de poder realizar cortes de pelvis, fundamentales para la evaluación de la enfermedad perianal con un de 97% de sensibilidad y un 96% de especificidad en el diagnóstico de fístulas anales.42
Dentro de los cambios murales que pueden detectarse con la e-RMN se encuentran el engrosamiento de la pared, la captación del contraste endovenoso en la mucosa inflamada, úlceras, edema de la pared, estenosis, dilataciones e infiltración grasa de la pared. Los hallazgos extramurales incluyen fístulas, tractos sinusales, abscesos, “signo del peine” -que traduce la ingurgitación de los vasos que irrigan la pared inflamada-, adenopatías y proliferación grasa en el mesenterio. Figura 4.
Figura 4. Imágenes en EII
Existen varios scores para monitoreo de actividad y respuesta a los tratamientos guiados por e-RMN. El primero y mejor validado es el Índice de Resonancia Magnética de Actividad (MaRIA), calculado a partir de predictores independientes tanto de la presencia de inflamación endoscópica (engrosamiento de la pared, realce de contraste mural) como de la presencia de ulceraciones endoscópicas (edema mural y ulceración detectada por RMN). Una puntuación MaRIA ≥ 7 indica enfermedad activa y ≥ 11 indican enfermedad grave (ulcerosa).43 Sin embargo, calcular la puntuación MaRIA lleva tiempo debido a que requiere la medición de la intensidad de la señal de la pared intestinal colocando manualmente múltiples regiones de interés. Además, los segmentos normales contribuyen a la puntuación MaRIA global y en pacientes con segmentos resecados se produce una subestimación de la puntuación global. Estos inconvenientes llevaron al desarrollo de la puntuación MaRIA simplificada (sMaRIA), que requiere mucho menos tiempo de cálculo y donde los segmentos normales no cuentan en la puntuación global. El sMaRIA también ha sido validado contra estándares endoscópicos de referencia.44, 45
La ecografía doppler intestinal es una metodología poco empleada a pesar de ser de suma utilidad para la evaluación de la enfermedad ileal. Tiene grandes ventajas, como ser poco invasiva, no requerir preparación con laxantes, no emitir radiaciones, ser económica y muy aceptada por los pacientes. Sus principales limitaciones son la incapacidad de evaluar todo el ID y la necesidad de entrenamiento para su realización, ya que es muy dependiente del operador. Una combinación de contraste de microburbujas intravenosas y modo de imagen de índice mecánico bajo o Doppler de potencia aumentan su sensibilidad. Permite medir vascularización e índices de resistencia; la medición del flujo en la arteria mesentérica superior aumenta la sensibilidad y especificidad.46 Sus principales utilidades son: determinar la presencia de actividad, diferenciar estenosis por fibrosis de estenosis por edema inflamatorio, evaluar la respuesta terapéutica y detectar una recidiva post-quirúrgica en EC. La ecografía ha mostrado una sensibilidad del 89% y una especificidad del 94,3% en la evaluación de los pacientes con EC conocida, pero es menos precisa para detectar lesiones proximales. Respecto al monitoreo del tratamiento, aunque no se ha establecido una definición definitiva de CM, algunos autores sugieren que la misma debería incluir el concepto de “transmuralidad”, sobre todo en EC, más estricto aún que la cicatrización de la mucosa.47 Allocca y col. demostraron que los pacientes con cicatrización endoscópica, pero con actividad ultrasónica residual tienen un mayor riesgo de un curso negativo de la enfermedad, incluido un aumento de las tasas de cirugía, hospitalización y necesidad de escalar el tratamiento.48
Existen otros métodos por imágenes en desarrollo o en período de evaluación de aplicabilidad real en la práctica diaria, como elastografía, medición de la motilidad (por eco o RMN), difusión como detección de actividad inflamatoria e inteligencia artificial con radiomics aplicado a la RMN que se correlaciona con la histología.44
Podemos concluir que los métodos por imágenes juegan un papel vital en el manejo de pacientes con EII y superan las limitaciones de la endoscopía, con la que se complementan. Está demostrada la utilidad de las imágenes para el diagnóstico, estadificación, evaluación de la actividad inflamatoria y clasificación de gravedad. Además, a medida que los objetivos del tratamiento van evolucionando hacia el logro de una remisión profunda sostenida, la RMN y la ecografía doppler son de suma importancia como herramientas objetivas para el seguimiento de la enfermedad y como determinantes de la respuesta transmural y la curación. La importancia de la curación en las imágenes es una prioridad de investigación actual.
Endoscopía
La endoscopía en la EII cumple múltiples funciones, en distintos momentos evolutivos del curso e historia de la enfermedad. Su rol combinado permite la evaluación mucosa directa y la toma de muestras para estudio histopatológico, y ha posicionado a la endoscopía como elemento indispensable dentro de las estrategias disponibles para el diagnóstico y seguimiento.49
Endoscopía en el diagnóstico de la EII:
Frente a la sospecha diagnóstica de EII la ileocolonoscopía con toma de biopsias es una de las principales intervenciones a implementar, ya que permite:50-52
• Establecer el diagnóstico
• Diferenciar EC de CU
•
Caracterizar extensión y severidad
• Excluir diagnósticos diferenciales
Establecer el diagnóstico: considerando que no existen hallazgos patognomónicos que permitan identificar un patrón endoscópico inequívoco de EII, múltiples hallazgos con la combinación de otras metodologías diagnósticas permiten arribar a un diagnóstico. La ileocolonoscopía está recomendada como una de las evaluaciones iniciales ante la sospecha de EII, ya que permite la visualización mucosa directa y la descripción de los hallazgos mucosos iniciales, además de ser la única técnica diagnóstica que tiene la capacidad de obtener material para estudio histopatológico. La toma de muestras de biopsias debe realizarse en los 5 segmentos anatómicos (íleon - ascendente - transverso - descendente y recto) extrayendo al menos 2 muestras de cada segmento, ya sea que estén sanos o afectados.53
La metaplasia de células de Paneth en colon distal, la depleción severa de mucina, un infiltrado inflamatorio denso, la distorsión y atrofia de las criptas con abscesos crípticos son hallazgos histológicos sugestivos de CU. En la EC suelen encontrarse: infiltrado inflamatorio segmentario, inflamación crónica de la lámina propia, preservación de mucina, criptitis focal o en parches. Los típicos granulomas no caseosos epitelioides no asociados a injuria críptica de la EC sólo se encuentran en 10 a 30% de las biopsias endoscópicas y en el 50% de las piezas quirúrgicas.54
Diferenciar EC de CU: determinadas características de los hallazgos endoscópicos pueden contribuir a la diferenciación entre ambos tipos de EII. La intensidad de los hallazgos guarda relación con la severidad de la actividad mucosa (Tabla 6).
Tabla 6. Patrones endoscópicos diferenciales entre CU y EC
Foto 1. Compromiso asimétrico de la EC
Foto 2. Colitis Ulcerosa severa con segmentos de mucosa
denudada
Caracterizar extensión y severidad: las manifestaciones clínicas de las EII pueden ser poco representativas del grado de extensión a nivel luminal del tubo digestivo. La heterogeneidad asociada a los fenotipos complejos de la Enfermedad de Crohn o la sintomatología intensa asociada al compromiso distal en la colitis ulcerosa hacen indispensable la caracterización de su extensión y severidad en forma objetiva. El grado de actividad debe expresarse con una descripción detallada que incluya los indicadores requeridos para la confección de los scores elegidos. La posibilidad de tomar muestras para estudio histopatológico permitirá definir histológicamente la extensión.
Excluir diagnósticos diferenciales: Los patrones clínicos, endoscópicos e histológicos de las EII no son específicos y múltiples patologías pueden simular una EII. Esto destaca no sólo la heterogeneidad de estas enfermedades, sino también la dificultad para determinar un diagnóstico de certeza. El diagnóstico diferencial incluye un amplio espectro de enfermedades inflamatorias que simulan EII u otras que pueden complicar la EII existente. Frente a la evaluación inicial, es preciso considerar variables adicionales: epidemiológicas, clínicas, familiares, antecedentes de otras patologías, tratamientos previos, estado inmune. Los diagnósticos diferenciales son muy diversos y de etiologías variadas y requieren de un enfoque multidisciplinario y exámenes complementarios adicionales.55, 56
Dentro de las enfermedades infecciosas cabe destacar la tuberculosis intestinal (TBC) que suele mimetizar a la EC ileocecal. La TBC es endémica en nuestra región y solo 15 a 30% de los casos se acompañan de compromiso pulmonar. La ausencia de compromiso perianal y la presencia de úlceras transversales con compromiso de pocos segmentos son características a favor de la TBC. El diagnóstico diferencial suele ser dificultoso, ya que la reacción de Mantoux es positiva en un 50% de los casos, la presencia de bacilos en las biopsias de colon es poco sensible (5-35%) al igual que la PCR (sensibilidad 44%, especificidad 95%) y el cultivo suele demorar 3 a 8 semanas. El método más útil pero no disponible en nuestro país es la prueba de liberación de interferón-gamma (IGRA) con una sensibilidad y especificidad del 80%.57, 58 Otra causa infecciosa a descartar es la amebiasis intestinal, de alta incidencia en Centroamérica, que suele presentarse con dolor abdominal, fiebre y diarrea con sangre.59
La afectación por ciertas drogas suele ser un desafío y se han descrito lesiones similares a EII causadas por antiinflamatorios y algunos medicamentos inmunosupresores como el micofenolato. Muchas veces el diagnóstico de certeza es dado por la desaparición de las lesiones al suspender las drogas.60, 61 Los nuevos tratamientos oncológicos inmunológicos denominados “inhibidores del control inmune” merecen una mención especial, ya que por un lado potencian el propio sistema inmune contra las células tumorales pero por el otro pueden generar -hasta en un 40% de los pacientes- efectos adversos inmunomediados indistinguibles de una EII; en estos casos sólo el antecedente del tratamiento permitirá llegar al diagnóstico, ya que las manifestaciones y el manejo clínico son iguales a los de la EII.62-64
La colitis isquémica es quizá la principal causa vascular que debe ser diferenciada de la EII. Debemos sospecharla en pacientes añosos, con aparición súbita de los síntomas y con colonoscopía que evidencia afectación de un sector bien definido, con úlceras lineales, signos de cianosis y recto conservado.65, 66 Entre otros diagnósticos a considerar debemos tener presente también la colitis peridiverticular, la proctitis actínica y la úlcera rectal solitaria.
Endoscopía en el seguimiento de las EII:
• Reevaluar extensión, severidad
• Respuesta al
tratamiento
• Curación mucosa
• Detección de displasia
Reevaluar extensión y severidad: el curso remitente y recidivante de las EII obliga a la reevaluación frente a alteraciones clínicas o de los exámenes complementarios en las enfermedades ya establecidas. Durante una reactivación luminal, la visualización directa permite reevaluar el grado de actividad, obtener material indispensable para la detección de infecciones concomitantes asociadas al brote (CMV por ejemplo) o reevaluar la extensión. La utilización de los múltiples scores disponibles permite trasladar a una clasificación objetiva información sujeta a la influencia subjetiva del operador; sin embargo estas clasificaciones no reemplazan la correcta y completa descripción de los hallazgos endoscópicos. Muchos de los scores disponibles cuentan con la ventaja de ser ampliamente difundidos o sencillos, pero algunos no han recibido la validación externa necesaria. Es indispensable para el endoscopista familiarizarse con su uso.67 Al momento de la evaluación endoscópica en el contexto de un brote de EII es preciso considerar en la descripción endoscópica aquellos hallazgos relevantes o con valor pronóstico: tamaño y profundidad de las úlceras68 y progresión en la extensión del compromiso69 o la presencia de pseudopólipos, definidos como islotes de mucosa remanente entre grandes extensiones de ulceración.
Foto 3. Pseudopólipos en colitis ulcerosa grave
Respuesta al tratamiento: frente a modificaciones de esquemas terapéuticos, la visualización directa aporta información objetivamente comparable de la respuesta y alcance de los objetivos deseados. En ocasiones el daño cicatrizal en forma de tractos lineales longitudinales o confluentes o la presencia de pólipos post inflamatorios (estructuras sésiles o digitiformes con superficie y coloración similar a la mucosa circundante) hacen evidente el daño previo, impidiendo el retorno de la mucosa a la normalidad pero evidenciando hallazgos secuelares no activos.
Curación mucosa: la confirmación del control de la actividad inflamatoria a nivel mucoso se ha posicionado como objetivo terapéutico, ya que representa un parámetro objetivo que permite equilibrar la toma de decisiones estratégicas, identificando pacientes en riesgo de progresión de la enfermedad, subtratados con enfermedad activa oligosintomática, de pacientes en riesgo de eventos adversos asociados al sobretratamiento innecesario. La curación mucosa está asociada a una disminución significativa del riesgo de recaídas, hospitalizaciones y cirugías.70
Foto 4. Pólipos post inflamatorios en CU en remisión con patrón vascular
conservado
Foto 5 y 6. Curación mucosa endoscópica en Colitis
Ulcerosa
Detección de displasia: la actividad inflamatoria mucosa está claramente relacionada con el riesgo de desarrollo de displasia y cáncer colorrectal, por medio de un efecto directo a través de una vía de carcinogénesis distintiva y también como un factor confundidor para la interpretación de los hallazgos histológicos.71-73 Sin embargo, la evidencia ha mostrado que este riesgo es mayor que en la población general, aunque no tan elevado como evidenciaban los metanálisis publicados a principios de los años 2000, posiblemente debido a la optimización de los tratamientos farmacológicos y la generalización de los programas de pesquisa y vigilancia.74-76 Con las técnicas endoscópicas actuales, la mayoría de las lesiones displásicas son visibles, lo que permite su caracterización y eventual resección endoscópica. El reconocimiento de los factores de riesgo en la EII para el desarrollo de displasia y las estrategias de pesquisa y terapéutica recomendadas han avanzado significativamente en los últimos años.
Con respecto a los factores de riesgo para el desarrollo de displasia, es fundamental identificarlos, ya que su presencia impacta en el inicio, intervalo y estrategias de pesquisa, siendo los más relevantes:77, 78
1. Antecedente familiar de cáncer colorrectal
2. Antecedente personal de displasia
colónica
3. Colangitis esclerosante primaria (CEP) y trasplante hepático
4. Edad temprana de debut de
la enfermedad
5. Severidad de la inflamación
6. Extensión del compromiso
7. Presencia de
estenosis, pólipos postinflamatorios
Distintas guías coinciden en el inicio de la pesquisa a los 8 a 10 años del debut de la enfermedad o al momento del diagnóstico en pacientes con CEP, ajustando los intervalos según los hallazgos y antecedentes (Tabla 7).
Tabla 7. Esquema de seguimiento colonoscópico de la EII recomendado
según riesgo individual del paciente
Una vez identificadas las poblaciones objetivo, la optimización de la técnica de pesquisa radica en la mejora de la calidad de los procedimientos endoscópicos por medio de la utilización de técnicas adecuadas para la detección y caracterización de lesiones y su adecuada descripción. Tanto los consensos de AGA/ASGE79 y ECCO50 coinciden en la necesidad de utilizar endoscopios de alta definición, sugiriendo la cromoendoscopía con colorantes vitales como adyuvante para aumentar la tasa de detección de lesiones; la evidencia científica más reciente avala la utilización de cromoendoscopía virtual con el mismo objetivo.80 Frente a la imposibilidad de contar con endoscopios de alta definición o técnicas endoscópicas avanzadas virtuales, cobran mayor relevancia recursos tales como la cromoendoscopía con colorantes vitales o los protocolos de biopsias al azar.
El objetivo de la pesquisa radica en identificar lesiones potencialmente resecables para proceder a la terapéutica endoscópica. Actualmente se avala la utilización de la Clasificación de Paris modificada para la descripción de lesiones visibles endoscópicamente. En caso de detección de displasia en muestras anatomopatológicas al azar (no relacionados a una lesión visible endoscópicamente) se sugiere la confirmación por medio de un endoscopista entrenado con utilización de técnicas avanzadas.
La elección de la terapéutica apropiada para las lesiones resecables diagnosticadas estará relacionada con diferentes variables:81
• Programar la terapéutica en el momento óptimo alcanzando el control de la inflamación, minimizando el uso de esteroides sistémicos y con preparación óptima.
• Elegir la técnica endoscópica más adecuada para el sitio y lesión a resecar (polipectomía convencional, disección submucosa o resección mucosa endoscópica) intentando la resección en bloque.
Videocápsula
Frente a determinadas situaciones donde las endoscopías convencionales no han permitido arribar a un diagnóstico preciso, la videocápsula cobra relevancia para la evaluación del intestino delgado en pacientes con sospecha de EC, para la confirmación de actividad o remisión mucosa, o ante el sangrado digestivo. Luego de una ileocolonoscopía negativa en un paciente sin síntomas de obstrucción, la realización de una videocápsula puede ser el medio para obtener información indispensable que guíe las decisiones terapéuticas. Si los hallazgos fueran negativos o el paciente presentara síntomas obstructivos, la sistemática de estudios deberá basarse en el diagnóstico por imágenes.53
Las EII son un desafío diagnóstico y terapéutico dada su heterogeneidad en presentación y evolución. El diagnóstico se realiza principalmente con endoscopia e imágenes que evidencian la inflamación intestinal. Idealmente la histología, junto con el patrón de la enfermedad, confirma la EC o la CU. Un diagnóstico cuidadoso es crítico para el manejo apropiado de cada paciente.
La presentación clínica no es suficiente para controlar la efectividad de los tratamientos. Debemos plantearnos metas precisas e ir controlando en forma periódica el cumplimiento de las mismas en pos de lograr una óptima calidad de vida y disminuir la discapacidad que pueden generar estas enfermedades. En la actualidad disponemos de novedosos y certeros métodos bioquímicos, de imágenes y endoscópicos que nos permiten realizar una evaluación objetiva de la inflamación y un manejo óptimo de nuestros pacientes.
Propiedad intelectual. Los autores declaran que los datos, las figuras y las tablas presentes en el manuscrito son originales y se realizaron en sus instituciones pertenecientes.
Financiamiento. Los autores declaran que no hubo fuentes de financiación externas.
Conflicto de interés. Los autores declaran no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor

© 2022 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Sobrero M J, Etchevers M J. Estrategias actuales en el diagnóstico y seguimiento de las enfermedades inflamatorias intestinales. Acta Gastroenterol Latinoam. 2022;52(3):306-321. https://doi.org/10.52787/agl.v52i3.242
Correspondencia: María Josefina Etchevers
Correo electrónico:
maria.etchevers@hospitalitaliano.org.ar
Acta Gastroenterol Latinoam 2022;52(3):306-321