Alejandro Moreira Grecco ID· Tomás Flores ID
División Cirugía Gastroenterológica. Hospital de Clínicas José de San
Martín.
Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2023;53(4):337-345
Recibido: 30/11/2023 / Aceptado: 24/12/2023 / Publicado online el 29/12/2023 / https://doi.org/10.52787/agl.v53i4.375
Se presenta una revisión sobre los diferentes tratamientos para la incontinencia fecal, con especial énfasis en los resultados de los procedimientos quirúrgicos para esta afección. La revisión aborda un enfoque integral y personalizado para el manejo de los pacientes con incontinencia fecal, que es de capital importancia, en el que se deben ponderar los resultados de las diferentes opciones terapéuticas en su relación con la calidad de vida de los pacientes. Por último, se sugiere un algoritmo de tratamiento para dicha condición.
Palabras claves. Neuromodulación sacra, incontinencia fecal, tratamiento, pérdida no deseada de heces, estimulación del nervio sacro, esfinteroplastia, biofeedback.
A review of the different treatments for fecal incontinence is presented, with special emphasis on the results of surgical procedures for this condition. It addresses a comprehensive and personalized approach to the management of patients with fecal incontinence, which is of capital importance, where the results of the different therapeutic options must be weighed in their relationship to the quality of life of the patients. Finally, a treatment algorithm for said condition is suggested.
Keywords. Sacral neuromodulation, fecal incontinence, treatment, unwanted loss of feces, sacral nerve stimulation, sphincteroplasty, biofeedback.
Abreviaturas
IBF: Biofeedback.
CMC: Carboximetilcelulosa.
CCF-FI: Cleveland Clinic
Florida-Fecal Incontinence.
NASHA Dx: Dextranómero en ácido hialurónico
estabilizado.
TPTNS: Estimulación transcutánea del nervio tibial posterior.
GA: Goma
arábiga.
IF: Incontinencia fecal.
FISI: Índice de Severidad de Incontinencia
Fecal.
NICE: National Institute for Health and Care Excellence.
SNM: Neuromodulación
sacra.
FODMAP: Oligosacáridos fermentables, disacáridos, monosacáridos y
polioles.
FD: Suplementos de fibra dietética.
La incontinencia fecal (IF) se define, de acuerdo con los criterios de Roma IV, como “la pérdida incontrolada y recurrente de materia fecal durante al menos 3 meses”.1 Presenta una prevalencia del 0,4% al 18% en la población general y de hasta el 8,3% en los adultos no institucionalizados.2 En la Argentina, la prevalencia de IF es del 1,7% en la población adulta, según un estudio de Olmos y col.3 La estigmatización y la vergüenza que sufren los que la padecen hace que exista un subregistro de la afección. Sin embargo, incluso entre los pacientes que buscan atención médica, existe una falta de documentación adecuada del problema. Esta falta de diagnóstico es aún más pronunciada en la población mayor de 65 años, en quienes la afección a menudo se atribuye a factores médicos y no recibe la atención merecida.4
La IF tiene un impacto perjudicial en la calidad de vida de las personas afectadas. Por lo tanto, los objetivos del tratamiento son reducir la frecuencia y la gravedad de los episodios y, en última instancia, mejorar la calidad de vida en general.5 Sin embargo, cabe señalar que actualmente no existe una cura para la IF y que el objetivo principal del tratamiento es mejorar los síntomas. La comunicación médico-paciente es esencial para nivelar las expectativas sobre los resultados del tratamiento instituido. Teniendo en cuenta la carga económica que la misma produce, es crucial centrarse en prevenir y tratarla eficazmente.
El manejo de la IF puede ser conservador o quirúrgico. Se recomiendan cambios en la dieta y el estilo de vida, medicamentos, ejercicios de los músculos del suelo pélvico y terapia física/biofeedback como terapias de primera línea. Las guías del National Institute for Health and Care Excellence (NICE) proponen abordar algunas condiciones antes de escalar el tratamiento, tales como mejorar la calidad de la materia fecal y las diarreas crónicas (infecciosas, enfermedad inflamatoria intestinal y síndrome de intestino irritable), descartar cáncer colorrectal, prolapso rectal o hemorroides de tercer o cuarto grado o síndrome de cauda equina o prolapso agudo del disco.6 A continuación, se busca mejorar el hábito intestinal del paciente, apuntando a lograr una consistencia de heces ideal y un vaciado intestinal satisfactorio en un momento predecible.1
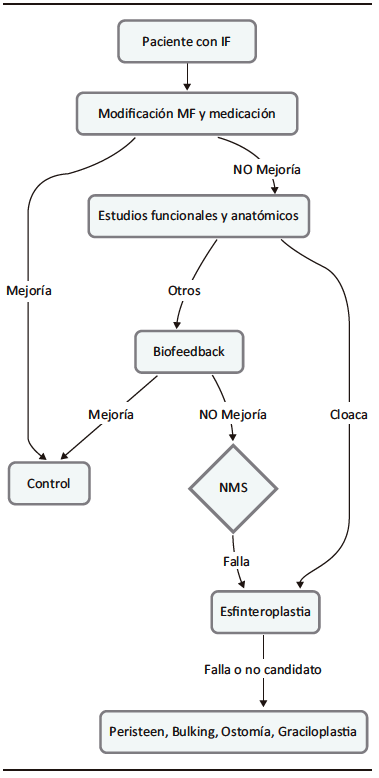
En los casos en los que el tratamiento médico es ineficaz, la estimulación del nervio sacro, agentes de aumento de volumen inyectables o tratamiento quirúrgico son opciones viables.7 Se propone el siguiente algoritmo de tratamiento (Figura 1).
Figura 1. Algoritmo propuesto para el tratamiento de la
incontinencia fecal
Dieta, tratamiento farmacológico y modulación de la materia fecal
Las recomendaciones de la Sociedad Europea de Coloproctología y otras sociedades europeas sugieren modificar la dieta de la siguiente manera: consumo suficiente de agua, ingesta adecuada de fibra, reducción del consumo de cafeína, disminución de la ingesta de oligosacáridos fermentables, disacáridos, monosacáridos y polioles (FODMAP), cesación del tabaquismo y pérdida de peso en pacientes con sobrepeso.8 El asesoramiento dietético especializado y dirigido al tratamiento de la IF tiene un efecto positivo en los síntomas. En un estudio sobre 50 pacientes con IF, las puntuaciones del Índice de Severidad de Incontinencia Fecal (FISI) y el Cuestionario de Calidad de Vida relacionada con la Incontinencia Fecal (FIQL) mejoraron significativamente después de recibir orientación dietética (FISI: 19 antes vs. 10,5 después, p < 0,001; FIQL: 2,9 antes vs. 3,2 después, p < 0.001).9 La orientación dietética individualizada es efectiva para mejorar los síntomas de IF. Una dieta baja en FODMAP podría ayudar a reducir el número medio de síntomas de IF. Un estudio realizado por Menees y col. en 2019 examinó los efectos de esta dieta en pacientes con IF; incluyó a 65 pacientes con IF que recibieron educación dietética formal (dieta baja en FODMAP) y reportó que el 64,6% de ellos tuvieron una reducción en sus síntomas de IF.10
Las farmacoterapias, que incluyen agentes para aumentar el volumen de las heces, como el polycarbophil de calcio, y agentes constipantes, como la loperamida, codeína, amitriptilina, atropina y difenoxilato, se han utilizado para manejar la IF.11 El clorhidrato de loperamida es el fármaco antidiarreico de primera elección para la incontinencia fecal asociada con heces blandas. Se recomienda iniciar con una dosis baja y aumentarla hasta lograr el control de los síntomas sin provocar estreñimiento molesto. Se puede utilizar en dosis de hasta 16 mg al día de manera continua.12 Antidepresivos como la amitriptilina y el valproato sódico también se han estudiado por su potencial para mejorar la función del esfínter anal.9,13
Algunos pacientes se benefician al modificar la ingesta de fibra (ya sea aumentándola o reduciéndola, dependiendo de la dieta existente y la consistencia de las heces). Los suplementos de fibra dietética (FD) han demostrado mejorar la IF.9 La suplementación de fibra, especialmente el psyllium, ayuda a reducir los episodios de incontinencia fecal. Los efectos principales de estos tratamientos incluyen una reducción en los síntomas de la IF y una mejora en la calidad de vida de los pacientes.14 El porcentaje de mejoría en los síntomas varía según el tratamiento y las características individuales del paciente. Bliss y col. asignaron los pacientes a tres grupos durante 31 días: 25 g de suplementación diaria de 7g de psyllium, 25 g de suplementación diaria de goma arábiga, y 0,25 g de pectina (como placebo). Se observó un número significativamente menor de episodios de IF en los grupos de psyllium y goma arábiga en comparación con el grupo de placebo, diferencia de media (MD) −0,33 (IC del 95%: −0,38, −0,28) y mMD−0,32 (IC del 95%: −0,37, −0,27) respectivamente.15 En otro reporte, los pacientes fueron asignados a uno de cuatro grupos: carboximetilcelulosa (CMC), goma arábiga (GA), psyllium o placebo, durante 52 días. Se administró una cantidad promedio de 16,6, 14,6 y 16,2 g/día para GA, psyllium y CMC, respectivamente. El número medio de episodios de IF después del período de tratamiento fue significativamente menor en el grupo de psyllium en comparación con el de placebo (p = 0,003), significativamente mayor en el grupo de CMC en comparación con el de placebo (p < 0,001) y no se observó una diferencia significativa entre el grupo de GA y el grupo de placebo (p = 0,92). La gravedad de la incontinencia fecal fue significativamente menor en el grupo de psyllium (p = 0,03), significativamente mayor en el grupo de CMC (p < 0,01) y no se encontró una diferencia significativa en el grupo de GA en comparación con el grupo de placebo (p = 0,81).16
Se presenta también la posibilidad de combinar la loperamida con psyllium para potenciar sus resultados.17
Biofeedback
El ejercicio del suelo pélvico (biofeedback, BF) consiste en educar a los pacientes sobre la coordinación del suelo pélvico, el reconocimiento de los umbrales sensoriales y el acondicionamiento de la musculatura pélvica, ayudándolos a desarrollar una mejoría en los hábitos del suelo pélvico. Tiene como objetivo mejorar la sensorialidad rectal, la coordinación y la fuerza muscular.
Existen varias maneras de realizarlo; la más común es a través de la colocación de una sonda introducida en el ano para controlar la fuerza y la coordinación de los esfínteres y el elevador del ano. Al transmitir los datos de la sonda a un monitor, los pacientes pueden ver una representación de la actividad del suelo pélvico durante la defecación.
Es una terapia de primera línea para pacientes con IF, a pesar de que algunos estudios no han encontrado una ventaja significativa del BF sobre el consejo y la reeducación.18
La terapia de BF puede mejorar la sensación rectal, la coordinación entre la percepción de distensión rectal y la contracción del esfínter externo en pacientes con sensación rectal reducida. En un estudio que involucró a 124 pacientes, Regadas y col. encontraron una reducción del 50% en las puntuaciones de IF en aproximadamente el 50% de los pacientes.19 Los pacientes con puntuaciones del Cleveland Clinic Incontience (CCF-FI) ≥ 10, parto vaginal previo, antecedente de cirugía anorrectal y/o colorrectal y contracción voluntaria por manometría disminuida fueron menos propensos a responder a la terapia de BF.
Norton y col., en un ensayo controlado aleatorizado, incluyó a un total de 171 participantes y comparó cuatro grupos diferentes: educación (grupo 1), educación más ejercicios del esfínter (grupo 2), educación más ejercicios del esfínter más BF clínico (grupo 3) y educación más ejercicios del esfínter más BF clínico más BF domiciliario (grupo 4). No se encontraron diferencias significativas entre ninguno de los grupos en cuanto al número medio de episodios de incontinencia fecal por semana (p = 0,51), la gravedad de la IF (Índice de St. Mark’s) (p = 0,54) o la calidad de vida después de un seguimiento de 1 año. Sin embrago, la calidad de vida, el formulario SF 36 y la escala de Ansiedad y Depresión mejoraron significativamente. Los pacientes mejoraron las presiones de reposo y contracción sostenida (p < 0,002), manteniéndolas hasta el año de seguimiento.6
Heymen y col. evaluaron, en un ensayo controlado, el número de días por semana con IF y reportaron que el número medio de días con IF por semana fue significativamente menor después de 3 meses en el grupo de BF en comparación con el grupo de ejercicios de suelo pélvico MD 0,77; IC95% [IC] 0,11, 1,43. Los participantes en el grupo de BF mostraron reducciones significativamente mayores en la gravedad de la IF (FISI) en comparación con los participantes en el grupo de ejercicios de suelo pélvico después de 3 meses (MD de 35 a 22,5 vs. de 37 a 32; p = 0,01).20
Estimulación del nervio tibial
El nervio tibial posterior contiene fibras sensitivas, motoras y autonómicas que se originan a partir de las raíces del plexo sacro S2-S4. Su estimulación provoca que se estimulen de forma retrógrada las raíces sacras relacionadas con el control visceral y muscular del suelo pélvico. Dentro de sus efectos, se incluye la estimulación aferente de la percepción sensorial rectal y de la musculatura estriada, con el consiguiente aumento de la presión máxima de contracción y de reposo. La estimulación del nervio tibial se puede realizar de manera percutánea o transcutánea. La estimulación transcutánea del nervio tibial posterior (Transcutaneous Posterior Tibial Nerve Stimulation, TPTNS) parecería no tener efectos sobre la IF.21 En un metaanálisis, los participantes en el grupo de estimulación nerviosa tibial posterior percutánea (TPTNS) tuvieron un número medio significativamente menor de episodios de IF por semana en comparación con el grupo simulado, con una diferencia de media de -3,01 (IC del 95% -4,52, -1,5), con una duración de seguimiento que osciló entre 3 y 12 meses.22 La TPTNS es efectiva para reducir el número promedio de episodios de IF por semana; sin embargo, la gravedad y la calidad de vida no mostraron diferencias significativas entre los grupos de TPTNS y de simulación.
La neuromodulación sacra es superior a la TPTNS para tratar la IF. Una revisión realizada por Simillis y col. incluyó cuatro estudios, de los cuales uno fue un ensayo clínico aleatorizado y tres fueron estudios prospectivos no aleatorizados, con un total de 302 pacientes evaluados.23 El período de seguimiento varió entre 3 y 12 meses. El número medio de episodios de IF por semana se evaluó en dos estudios (n=214) y fue significativamente menor en el grupo de neuromodulación sacra (SNM) en comparación con el grupo de TPTNS: diferencia de medias ponderada (WMD) 8,11 (IC del 95% 4,13, 12,09). La gravedad de la IF (medida mediante la escala CCF-FI) se evaluó en los cuatro estudios (n=293) y fue significativamente menor en el grupo de SNM en comparación con el grupo de PTNS: WMD 2,27 (IC del 95% 1,12, 3,42). La calidad de vida (evaluada mediante el cuestionario FIQoL) se evaluó en dos estudios (n=91) y fue significativamente mejor en el grupo de SNM en comparación con el grupo de PTNS en los dominios de afrontamiento, depresión y autopercepción: WMD 0,51 (IC del 95% 0,16, 0,86) y WMD 0,4 (IC del 95% 0,11, 0,69), respectivamente. La SNM fue superior a la TPTNS en términos de un menor número promedio de episodios de IF por semana, una menor gravedad de la IF y una mejor calidad de vida en los dominios de afrontamiento y depresión de la escala FIQoL. Sin embargo, los eventos adversos parecen ser ligeramente más frecuentes y levemente más graves en el tratamiento con SNM en comparación con PTNS.
Opciones quirúrgicas para el manejo de la incontinencia fecal
Neuroestimulación sacra
La SNM se utiliza como alternativa a las intervenciones quirúrgicas invasivas para el tratamiento de la IF24 y se ha establecido como una terapia segura y efectiva a largo plazo para la incontinencia fecal.25,26 La SNM se plantea como segunda línea de tratamiento para la IF luego de la falla del tratamiento médico, con un alto nivel de evidencia.27 Ha llegado a ser el tratamiento quirúrgico preferido para la incontinencia fecal aun en pacientes con lesiones en el esfínter anal.28
La SNM está indicada para tratar la IF en los siguientes escenarios: (i) tratamiento conservador no exitoso, (ii) defectos del esfínter de hasta 90 grados, (iii) recuperación de una resección anterior baja, (iv) síndrome de cauda equina y (v) malformación congénita.27
Las contraindicaciones relativas para el SNM incluyen la enfermedad neurológica
severa o rápidamente progresiva o la anatomía sacra anormal. La implantación consta de dos fases; la primera
de prueba, en la que se determina si el tratamiento aporta beneficios al paciente en particular, con la
colocación de un electrodo a nivel de la segunda vértebra sacra (S2), y la segunda de implante definitivo,
el cual se realiza solo en los pacientes que tuvieron éxito en la fase de prueba (Figura 2).
Se
considera una fase de prueba exitosa cuando, en un lapso de 2 a 3 semanas, los síntomas mejoran en más del
50%.
Figura 2. Radioscopía de fase de implementación de neuromodulador
sacro. Se observa el electro en forma de “jota” a nivel del foramen de S2 (flecha blanca) y el generador
subcutáneo ya implantado en el glúteo izquiedo (flecha negra). La implantación se realiza bajo sedación
anestésica y en forma ambulatoria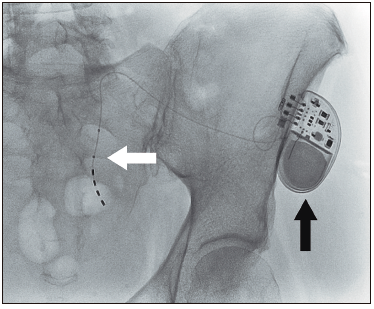
La SNM resulta en una menor cantidad media de episodios semanales, menor gravedad de la IF y una mejor calidad de vida.29 Un estudio de cohorte reportó que la SNM era un tratamiento mínimamente invasivo asociado con una baja morbilidad, y mostró mejoría del 40% en los puntajes de IF y un 25% de mejoría en la calidad de vida en un porcentaje significativo de pacientes.30
En el estudio de Tjandra y col., se incluyó a un total de 120 participantes, de los cuales 7 participantes del grupo de SNM no pasaron la fase de prueba.31 El número medio de episodios de IF fue significativamente menor en el grupo de SNM en comparación con el grupo de tratamiento conservador, tanto a los 3 meses (2,9 vs. 8,1) como a los 12 meses (3,1 vs. 9,4), MD −5,2 (IC del 95%: −9,15, −1,25) y MD −6,3 (IC del 95%: −10,34, −2,26) respectivamente. La gravedad de la IF fue significativamente menor en el grupo de SNM en comparación con el grupo de tratamiento conservador a los 3 y 12 meses, MD −11 (IC del 95%: −11,60, −10,40) y MD −12,90 (IC del 95%: −13,85, −12,22) respectivamente. La calidad de vida fue significativamente mayor para el grupo de SNM en comparación con el grupo de tratamiento conservador en los cuatro dominios, tanto a los 3 meses como a los 12 meses.
Con la utilización de los nuevos generadores recargables, un 87% de los pacientes reportó al menos un 50% de mejoría en los episodios de IF a las cuatro semanas, con una disminución de los episodios semanales de IF de entre un 75% y un 79% a las cuatro semanas y a los seis meses.32
La aplicación exitosa de la SNM es posible en Latinoamérica y en la Argentina.33 Oliveira y col. concluyen que la SNM es segura y eficaz, incluso en países con menos recursos económicos o menos desarrollados, luego de realizar un estudio sobre 131 pacientes en el cual el estimulador se colocó en forma permanente en 129 pacientes (98,5%).34 Además, reportaron un 14,7% de morbilidad, incluyendo infección (3,8%), dolor en el sitio de implante (3,8%), desplazamiento del generador/electrodo (3,8%), mal funcionamiento del dispositivo (2,3%) y hematoma (0,7%). La tasa de extracción del dispositivo fue del 2,2%. En un seguimiento medio de 36,7 meses (rango 1-84), la Escala de IF mejoró significativamente desde una línea de base preoperatoria de 15,9 ± 2,98 a 5,2 ± 3,92 (p < 0,0001). En general, el 90% de los pacientes calificó su mejoría como “significativa”.
Esfinteroplastia
La esfinteroplastia es el tratamiento quirúrgico ofrecido para la IF. Esta tiene como objetivo reconstruir la anatomía del esfínter anal y zona de alta presión, y consiste en la sutura de los cabos musculares seccionados, solapándolos. La otra alternativa es la esfinterorrafia. Se propone una esfinteroplastia por superposición en los pacientes con lesión esfintérica que no supere los 120°, o con una reparación posanal para los que no la presentan (Figura 3).35 Si bien la mayoría de los pacientes presenta inicialmente una mejoría de los síntomas, los resultados empeoran con el tiempo. La esfinteroplastia ofrece buenos resultados a corto y mediano plazo en continencia y calidad de vida para el tratamiento de la IF obstétrica. En un estudio español sobre 35 pacientes, con un seguimiento posoperatorio de 30 meses, el CC-FIS mejoró significativamente desde 15,7 ± 3,1 en el preoperatorio hasta 6,1 ± 5 (p < 0,001), y a los 110 meses aumentó a 8,4 ± 4,9 (p = 0,04).36 A pesar del cambio del CC-FIS, no hubo diferencias significativas entre los dos períodos de seguimiento en términos de calidad de vida.
Figura 3. Esfinteroplastía por superposición. Se encuentran
disecados los dos cabos del esfínter anal, se prefiere la disección en masa de ambos esfínteres y la
plástica con superposición de los cabos (Overlaping). Las flechas blancas marcan los cabos ya
disecados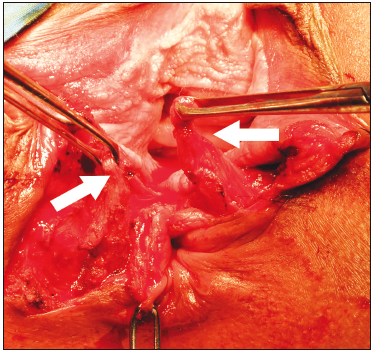
La esfinteroplastia puede presentar un resultado a largo plazo aceptable o excelente en hasta un 60% de los pacientes. Los predictores de peor resultado son la edad avanzada (≥ 50 años) en el momento de la cirugía, una infección profunda de la herida y los defectos aislados del esfínter anal externo.37 Sin embargo, otros reportes no han encontrado esta pérdida de efectividad de la cirugía.38
La esfinteroplastia se impone en los casos en los que existe una cloaca, donde además de la reparación esfitnerianaexite una restitución de la anatomía anorrectal y vaginal. En estos casos, la reconstrucción se asocia con una mejoría de los síntomas de IF y una mejoría de la calidad de vida (Figura 4).39
Figura 4. Cloaca anogenital obstétrica. Existe una disrupción
completa del tabique ano vaginal con comunicación de la mucosa rectal con la mucosa vaginal, la zona de
alta presión anal está ausente39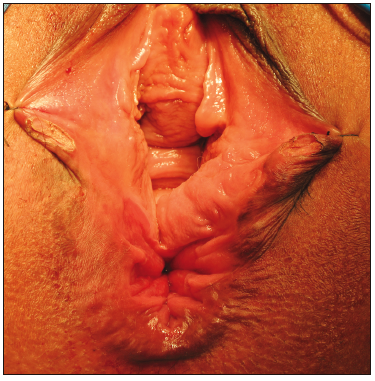
Sustancias de abultamiento
Se ha descrito la inyección de diferentes sustancias a nivel o alrededor del esfínter anal con el fin de generar un aumento de masa (bulking) a este nivel y, por consiguiente, obtener un aumento de la presión local y un efecto mecánico para el bloqueo de la salida de la materia fecal (Figura 5). La variedad de compuestos disponibles y de formas de inyección hace que su comparación sea compleja.
Figura 5. Manometría de alta resolución posterior a la inyección
submucosa de sustancias de abultamiento anal. Nótese la aparición de una zona de presión antes ausente
en la manometría de alta resolución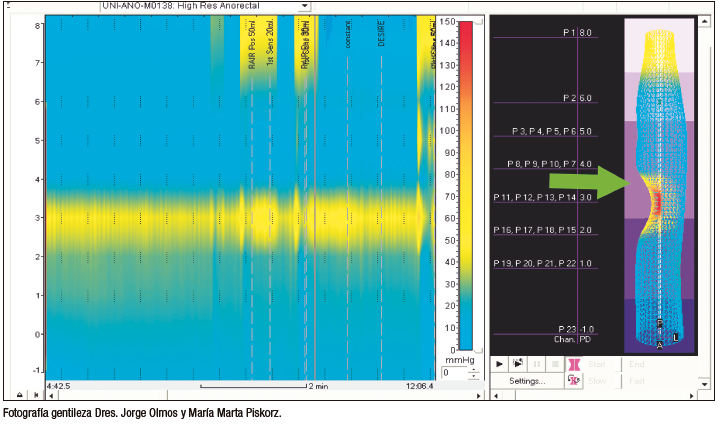
Graf y col. evaluaron a 278 pacientes, de los cuales 206 fueron asignados
aleatoriamente para recibir dextranómero en ácido hialurónico estabilizado (NASHA Dx) (n=136) o tratamiento
simulado (n= 70).
Setenta y un pacientes que recibieron NASHA Dx (52%) experimentaron una reducción del
50% o más en el número de episodios de incontinencia, en comparación con 22 pacientes que recibieron el
tratamiento simulado (31%; odds ratio 2,36, I del 95% 1,24-4,47, p = 0,0089). Se registraron 128
eventos adversos relacionados con el tratamiento, de los cuales dos fueron graves (1 absceso rectal y 1 absceso
prostático). La inyección anal de NASHA Dx es un tratamiento efectivo para la IF.40
En América Latina, se han utilizado sustancias para aumentar el volumen en el área anal con éxito. En un estudio sobre 53 pacientes con IF con puntajes CCF-FI entre 6 y 12, se obtuvo un tratamiento exitoso en el 60,4% de los pacientes con mejoría en los puntajes de incontinencia y en la calidad de vida.41 Las complicaciones asociadas a la inyección de agentes de masa son migración, infección, dolor, rechazo y, con el tiempo, una pérdida del efecto inicial debido a la difusión y cicatrización producidas alrededor del compuesto (Figura 6).
Figura 6. Inyección de sustancias (acrilatos) de abultamiento anal
(Bulking agentes) se realiza una inyección en los cuatro cuadrantes anales a fin de expandir la
submucosa del canal anal hacia la luz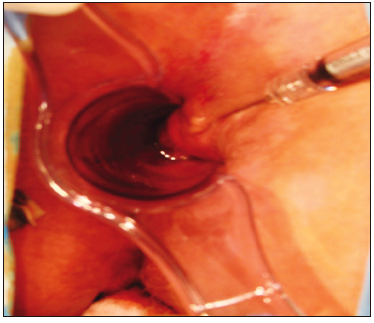
Mejorar los criterios de selección de los pacientes, la dosis y sustancia inyectada y el sitio ideal de inyección son necesarios para poder evaluar los efectos de estas terapias y, tal vez, aumentar su aceptación como tratamiento mínimamente invasivo.
Otras terapias disponibles
Existen otras alternativas para el tratamiento de la IF. La derivación fecal es un método efectivo y seguro para tratar la IF cuando todas las demás opciones han fallado. Está especialmente indicada en casos de IF neurogénica grave, defecto completo del músculo esfínter refractario a la intervención quirúrgica e incontinencia grave por radiación.
La irrigación anal (Peristeen) disminuye la gravedad de la IF y mejora la calidad de vida, con una menor frecuencia de infecciones del tracto urinario y tasas de confección de ostomía.42
También, se han descrito la aplicación de células madre, la radiofrecuencia, la graciloplastia, el esfínter magnético y el esfínter artificial para el tratamiento de la incontinencia fecal.
Existe un amplio espectro de opciones para el tratamiento de la IF. Su implementación se realiza desde los menos invasivos y más económicos hacia los más invasivos y onerosos. A pesar de las diversas modalidades terapéuticas, el desafío radica en la personalización del tratamiento para optimizar los resultados a largo plazo y mejorar la calidad de vida de los pacientes, considerando los beneficios, las limitaciones y los posibles riesgos de cada estrategia.
Propiedad intelectual. Los autores declaran que los datos y las figuras presentes en el manuscrito son originales y se realizaron en sus instituciones pertenecientes.
Financiamiento. Los autores declaran que no hubo fuentes de financiación externas.
Conflicto de interés. Los autores declaran no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor

© 2023 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Moreira Grecco A y Flores T. Tratamiento de la incontinencia fecal: una visión quirúrgica. Acta Gastroenterol Latinoam. 2023;53(4):337-345. https://doi.org/10.52787/agl.v53i4.375
Referencias
Correspondencia:
Alejandro Moreira Grecco
Correo electrónico: a_moreira_grecco@hotmail.com
Acta Gastroenterol Latinoam 2023;53(4):337-345