José M. Remes-Troche1 ID· José Luis Vargas-Basurto1 ID· Luis Valdovinos-García2 ID
1 Laboratorio de Fisiología Digestiva y Motilidad
Gastrointestinal. Instituto de Investigaciones Medico-Biológicas, Universidad Veracruzana,
Veracruz.
2 Departamento de Cirugía Experimental, Instituto Nacional de
Ciencias Médicas y Nutrición Salvador Zubirán, Ciudad de México.
Acta Gastroenterol Latinoam 2024;54(2):119-138
Recibido: 06/05/2024 / Aceptado: 05/06/2024 / Publicado online el 30/06/2024 / https://doi.org/10.52787/agl.v54i2.414
Los bloqueadores ácidos competitivos de potasio (P-CABs), como vonoprazan, fexuprazan, tegoprazan y revaprazan, representan una clase innovadora de medicamentos diseñados para tratar afecciones relacionadas con la secreción de ácido gástrico, incluida la enfermedad por reflujo gastroesofágico (ERGE), la infección por Helicobacter pylori (Hp) y la enfermedad ulcerosa péptica. Estos fármacos actúan inhibiendo de manera reversible y competitiva la bomba de protones H+/K+-ATPasa, lo cual les permite suprimir la producción de ácido gástrico de forma más efectiva y con una rapidez superior en comparación con los inhibidores de la bomba de protones (IBP) tradicionales. Además, estos fármacos no se ven interferidos por la enzima CYP2C19 y su efecto es independiente de la ingesta de alimentos, lo que les confiere ventajas sobre la mayoría de los IBP. Los estudios clínicos han demostrado que los P-CABs son superiores a los IBP en el manejo de la ERGE erosiva severa, y no inferiores en los grados leves y en la enfermedad no erosiva. Por otra parte, los P-CABs ofrecen tasas de erradicación de Hp no inferiores y, en algunos casos, superiores a las de los IBP, en los tratamientos de primera línea, pero no en los de segunda. En conclusión, los P-CABs emergen como alternativas prometedoras en el manejo de trastornos gastrointestinales ácido-dependientes.
Palabras claves. P-CAB, IBP, enfermedades relacionadas con el ácido, secreción de ácido gástrico, fexuprazan, tegoprazan, vonoprazan, revaprazan.
Potassium competitive acid blockers (P-CABs), such as vonoprazan, fexuprazan, tegoprazan and revaprazan are an innovative class of drugs designed to treat conditions related to gastric acid secretion, including gastroesophageal reflux disease (GERD), Helicobacter pylori (Hp) infection and peptic ulcer disease. These drugs work by reversibly and competitively inhibiting the H+/K+-ATPase proton pump, which allows them to suppress gastric acid production more effectively and faster than traditional proton pump inhibitors (PPIs). In addition, these drugs are not affected by the CYP2C19 enzyme and their effect is independent of food intake, giving them advantages over most PPIs. Clinical studies have shown that P-CABs are superior to PPIs in the treating of severe erosive GERD and non-inferior in mild and non-erosive disease. In addition, P-CABs offer non-inferior and in some cases superior Hp eradication rates to PPIs in first-line treatment, but not in second-line treatment. In conclusion, P-CABs are emerging as promising alternatives in the treatment of acid-dependent gastrointestinal disorders.
Keywords. P-CAB, PPI, acid-related diseases, gastric acid secretion, fexuprazan, tegoprazan, vonoprazan, revaprazan.
Abreviaturas
P-CAB: Bloqueador competitivo de los canales de
potasio.
ERGE: Enfermedad por reflujo
gastroesofágico.
IBP: Inhibidor de bomba de
protones.
IC: Intervalo de confianza.
CCK2R:
Receptor de colecistoquinina 2.
ECL: Células similares a las
enterocromafines.
H2R: Receptor de histamina
H2.
HCI: Ácido clorhídrico.
ACh:
Acetilcolina.
H+: Iones de hidrógeno
K+:
Potasio.
CYP: Citocromo.
Hp: Helicobacter
pylori.
EE: Esofagitis erosiva.
ERNE: Enfermedad
por reflujo no erosiva.
Los bloqueadores ácidos competitivos de potasio (P-CABs) representan una clase innovadora de medicamentos utilizados para tratar las enfermedades relacionadas con la secreción de ácido gástrico, como la enfermedad por reflujo gastroesofágico (ERGE) y la enfermedad ulcerosa péptica. La relevancia clínica de estas enfermedades radica en su alta prevalencia en la población y su cronicidad, haciendo imperativo un manejo terapéutico enfocado en la supresión efectiva del ácido gástrico. Con el avance de la farmacología, se han introducido diversos medicamentos destinados a mitigar estas afecciones, subrayando la importancia de comprender a fondo la fisiología detrás de la secreción gástrica para aprovechar al máximo su potencial terapéutico. A diferencia de los inhibidores de la bomba de protones (IBP), que requieren un ambiente ácido para activarse y forman un enlace covalente irreversible con la H+/K+-ATPasa, los P-CABs actúan de manera diferente. Se unen de forma reversible y competitiva al sitio activo de la H+/K+-ATPasa, lo que les permite inhibir la acción de la bomba de protones de manera inmediata y directa, independientemente del pH del entorno. Esta característica proporciona una inhibición más rápida del ácido gástrico y puede ofrecer una recuperación más ágil de la función estomacal una vez que se suspende el tratamiento.1
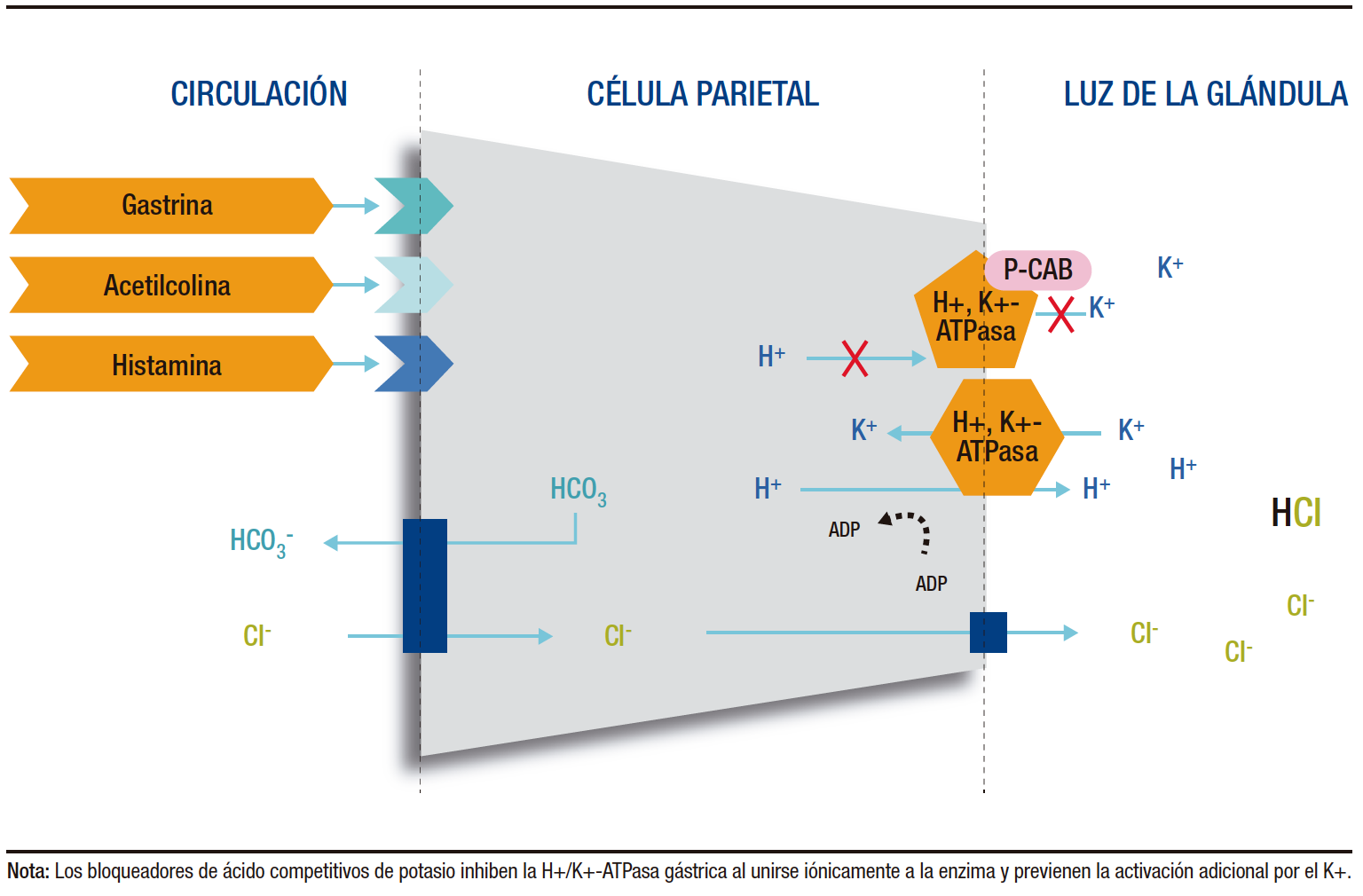
La secreción de ácido gástrico está mediada por distintos mecanismos, los cuales se complementan y refuerzan entre sí para optimizar la producción de ácido. La ingesta de alimentos activa las células G para liberar gastrina en el sistema circulatorio. Esta hormona estimula el receptor de colecistoquinina 2 (CCK2R) de las células similares a las enterocromafines (ECL) y estimula directamente a las células parietales. La estimulación de CCK2R en las células ECL promueve la producción y liberación de histamina. La histamina, a su vez, actúa de manera paracrina sobre los receptores H2 (H2R) en las células parietales, lo que promueve la producción de ácido clorhídrico (HCl) por parte de las células parietales mediante la bomba H+, K+-ATPasa. Paralelamente, la ingesta de comida activa reflejos neurales que activan el nervio vago, el cual libera acetilcolina (ACh). La acetilcolina interactúa con los receptores muscarínicos M3 en las células parietales, fomentando así la producción adicional de ácido clorhídrico (Figura 1).2-4 La producción de ácido gástrico por las células parietales ocurre a través de un proceso de intercambio iónico, en el cual los iones de hidrógeno (H+) dentro de la célula se intercambian por iones de potasio (K+) en el lumen, utilizando la bomba de H+, K+-ATPasa. Esta bomba transporta los protones del citoplasma hacia afuera, contra un gradiente de concentración, mientras introduce iones de potasio desde el exterior hacia el interior de la célula. Este mecanismo conlleva a un intercambio iónico que mantiene la neutralidad eléctrica. Durante el funcionamiento de la bomba H+, K+-ATPasa, un sistema de transporte de membrana que intercambia iones cloruro (Cl−) por bicarbonato (HCO3−) compensa el desplazamiento de los iones H+, liberando bicarbonato al plasma y atrayendo un ion cloruro al citoplasma, lo que permite mantener una secreción de ácido gástrico sin alterar el equilibrio eléctrico.3-5 Cabe resaltar que las células parietales conservan una producción de ácido en un nivel constante y basal, aún en ausencia de estímulos. Dicha producción basal de ácido constituye cerca del 10% de la capacidad total de la célula parietal para generar ácido cuando se encuentra en estado de máxima estimulación.4
Figura 1. Secreción del ácido gástrico y su inhibición por parte de los
P-CABs
Hasta el advenimiento de los P-CABs, los IBP fueron considerados el estándar de oro como terapia antisecretora. Estos actúan inhibiendo de manera irreversible la enzima H+, K+-ATPasa, bloqueando de este modo la secreción de ácido gástrico. Tras su absorción, los IBP son excretados en el canalículo de las células parietales gástricas y convertidos en su forma activa, la sulfenamida, en ambientes altamente ácidos.6 Esta forma activa se une a través de un enlace covalente e irreversible a las bombas de protones activas expuestas en el canalículo. A pesar de esta inhibición irreversible, la supresión del ácido inducida por los IBP puede ser temporal, ya que aproximadamente el 20% de las bombas de protones gástricas se sintetizan cada 24 horas. Dado que los IBP tienen una vida media breve en la sangre, de apenas 1 a 3 horas, esto implica que una sola dosis de IBP puede no ser suficiente para alcanzar la máxima inhibición del ácido gástrico. Por tanto, podrían necesitarse entre 3 y 5 días de tratamiento continuo para lograr una supresión efectiva del ácido (Figura 2).1,5-7 Por consiguiente, se recomienda la administración de los IBP antes del desayuno para evitar interacciones con la comida que puedan disminuir su efectividad.6 Además, la mayoría de los IBP se metabolizan a través del citocromo P450 (CYP) 2C19, enzima que presenta un apreciable polimorfismo genético entre la población. Lo que significa que la dosificación estándar podría causar efectos adversos en personas con metabolismo lento mediado por CYP2C19.1,5
Figura 2. Curso temporal de la inhibición ácida por bloqueadores de canales de
potasio e inhibidores de la bomba de protones: simulación por computadora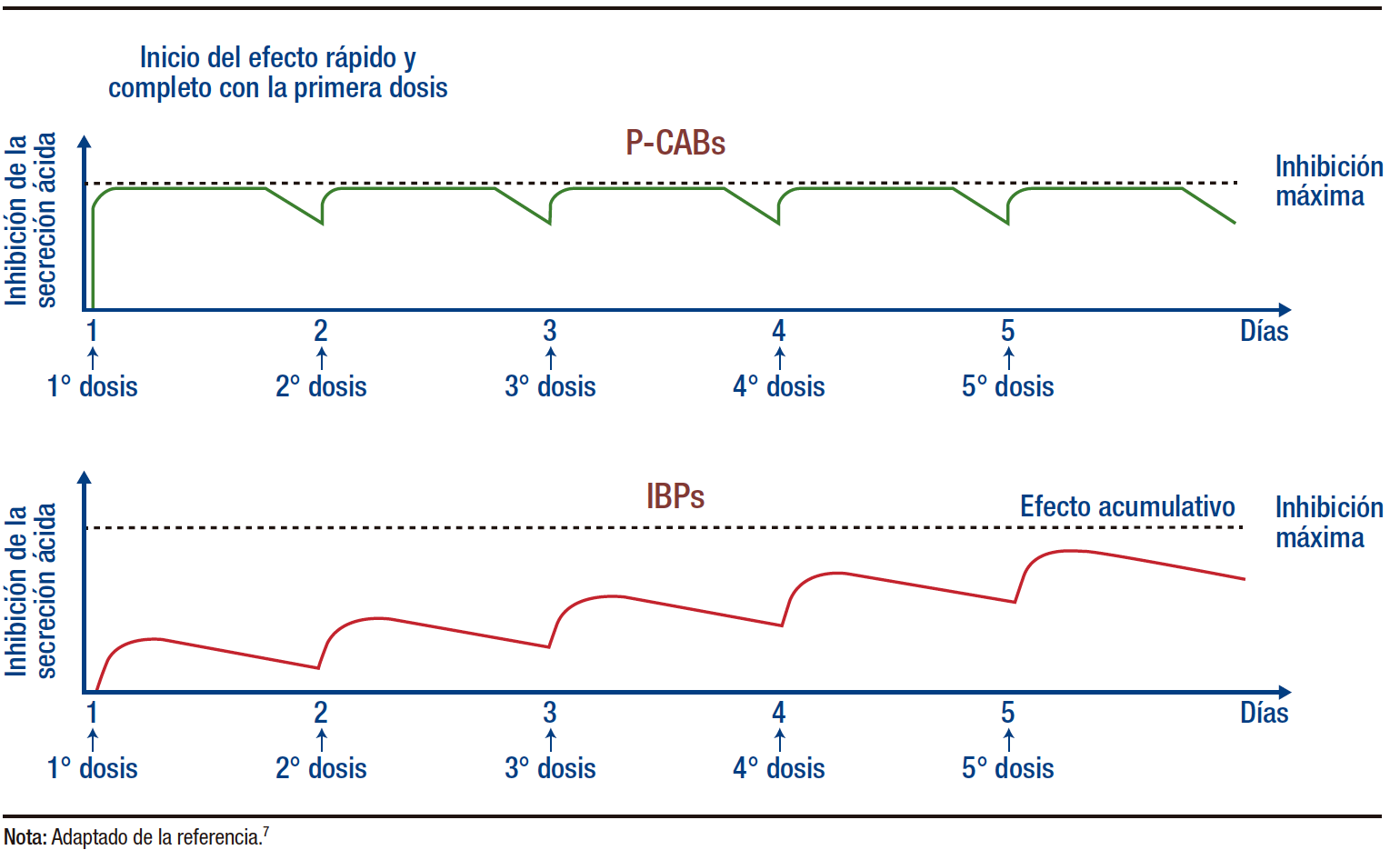
Los P-CABs representan una clase innovadora de medicamentos utilizados para tratar las enfermedades relacionadas con la secreción de ácido gástrico, para esto debemos comprender que el ion de potasio desempeña un papel esencial en la activación de la enzima H+/K+-ATPasa gástrica, siendo indispensable para su correcto funcionamiento. Cuando la enzima entra en contacto con el líquido luminal rico en K+, está capacitada para iniciar el intercambio de iones H+ por K+. Debido a esta función crítica en la elaboración de ácido gástrico, el K+ se considera un objetivo para los inhibidores de ácido, ya que los medicamentos que disputan el sitio de unión de K+ poseen la capacidad de inhibir la secreción de ácido.7-9
Los P-CABs son bases de naturaleza lipófila débil, con una estabilidad de pH limitada y altos valores de pKa. Estas propiedades les permiten acumularse en entornos ácidos, donde se unen de manera competitiva y reversible al sitio de unión de potasio en la ATPasa, bloqueando así el acceso del K+ a este punto crítico.7,10 En el entorno ácido de los canalículos de las células parietales, con un pH cercano a 1, un P-CAB con un pKa de 6,0 puede alcanzar concentraciones hasta 100.000 veces superiores a las encontradas en el plasma, que tiene un pH de 7,4. Al ingresar a estos canalículos ácidos, los P-CABs se protonan de inmediato, acumulándose en concentraciones mucho mayores que los IBP, ya que los compuestos protonados poseen una menor permeabilidad a través de las membranas comparados con los no iónicos, lo que les permite inhibir efectivamente la H+,K+-ATPasa (Figura 3).11,12
Figura 3. Comparación de mecanismos de acción de los IBPs vs. P-CABs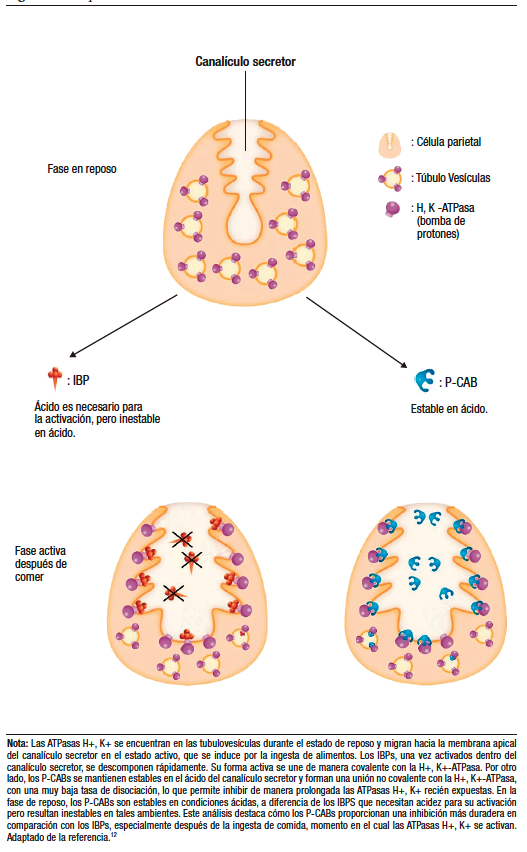
A diferencia de los IBP que requieren transformarse en una forma activa en presencia de entornos ácidos, los P-CABs pueden inhibir la bomba de protones directamente, sin la necesidad de una activación previa por el ácido. Además, tienen la ventaja de poder unirse tanto a las formas activas como inactivas de la ATPasa.7,10 Por lo tanto, se espera que la supresión ácida conseguida por los P-CABs sea más uniforme y esté menos influenciada por la producción de nuevas bombas de protones en las células parietales (Tabla 1).13 Esto resulta en la obtención rápida del máximo efecto supresor y en una prolongación del tiempo de acción, siempre y cuando se establezcan las condiciones farmacocinéticas apropiadas.8,10,11
Tabla 1. P-CABs e IBPs: Principales diferencias en el mecanismo de acción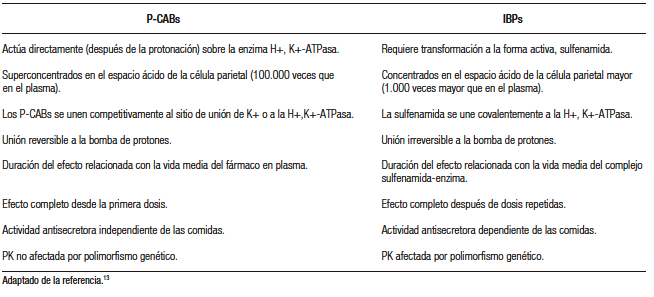
La clase P-CAB, en constante evolución, incluye fexuprazan, keverprazan, revaprazan, tegoprazan y vonoprazan, y otros en desarrollo, como linaprazan y zastaprazan. Vonoprazan, el más estudiado, fue aprobado en 201514,15 para tratar enfermedades relacionadas con el ácido (Tabla 2). Tegoprazan fue aprobado en Corea del Sur en 2019. En mayo de 2022, la Food and Drug Administration (FDA) aprobó regímenes de tratamiento para Helicobacter pylori (Hp) que contienen vonoprazan, y se aceptó la presentación de vonoprazan para el tratamiento de la esofagitis erosiva (EE). Actualmente, en Latinoamérica, fexuprazan, vonoprazan y tegoprazan han recibido la autorización de la autoridad sanitaria para su comercialización en países como Brasil, México y Colombia, entre otros. En los Estados Unidos hasta ahora solo ha sido autorizado el vonoprazan.
A continuación, se mencionan los principales P-CABs y la evidencia clínica al respecto:
Tabla 2. Indicaciones terapéuticas para el uso de P-CABs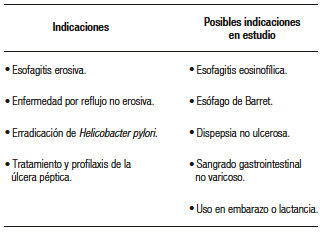
1. Vonoprazan
Vonoprazan, anteriormente conocido como TAK-438, es un derivado de pirrol, una estructura química diferente del resto de los P-CABs. Posee un pKa alcalino de 9,06, y muestra una alta capacidad para acumularse en áreas ácidas, como lo son los canalículos intracelulares de las células parietales.14,15 En la Tabla 3 podemos observar las características farmacocinéticas y farmacodinámicas de vonoprazan y diferentes P-CABs (a la dosis más alta probada).16
Tabla 3. Características farmacocinéticas y farmacodinámicas de los P-CABs aprobados
en Latinoamérica (a la dosis más alta probada)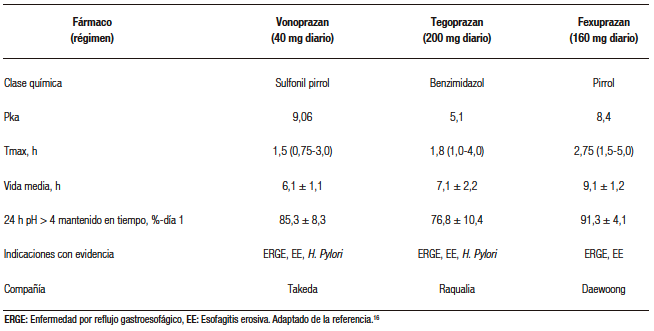
Al igual que otros P-CABs, vonoprazan demuestra afinidad tanto por las células parietales activas como inactivas, pero con una particularidad: se acumula en mayor medida en las glándulas gástricas en estado de reposo que en las activas. Esta acumulación en reposo podría explicarse debido a su rápido inicio de acción, en comparación con el lansoprazol. Vonoprazan ha mostrado una acumulación selectiva en la mucosa del cuerpo gástrico, especialmente en las células parietales, según se evidencia en estudios de autorradiografía.14,17,18 Se absorbe rápidamente y alcanza la concentración plasmática máxima en 2 h, pero la vida media plasmática fue mucho más larga: aproximadamente 7 h con 20 mg de vonoprazan en ayunas14 Vonoprazan es metabolizado en el hígado principalmente por la enzima CYP3A4, resultando en los compuestos M-I y M-III, indicando un camino metabólico distinto en comparación con los IBP. Aunque otras enzimas como CYP2D6, CYP2C9, CYP2C19 también juegan un papel en el metabolismo de vonoprazan, su contribución es menor. Los compuestos M-I-G y M-II-G se identifican como productos conjugados con ácido glucurónico de M-I y M-II, respectivamente.14,19
Durante los ensayos clínicos, no se observaron eventos adversos emergentes del tratamiento graves relacionados con el medicamento.20 En el referido ensayo de fase III, el perfil de seguridad de vonoprazan en la fase de mantenimiento hasta las 52 semanas fue similar al de lansoprazol.14,21 Es importante mencionar que la frecuencia de resultados anormales en las pruebas de función hepática en los grupos tratados con vonoprazan fue similar a la observada en el grupo de lansoprazol. No se observó un aumento en la toxicidad hepática durante la fase de largo plazo del estudio en ninguno de los grupos de vonoprazan, de 10 o 20 mg.14,21
La coprescripción de vonoprazan con medicamentos como atazanavir o rilpivirina está contraindicada debido a que la absorción de estos últimos puede reducirse por la influencia del ácido gástrico. Como vonoprazan inhibe la secreción de ácido de manera más intensa que los IBP, se observa un incremento en los niveles de gastrina sérica superior al que se registra con el uso de IBP.14 Este aspecto es particularmente relevante en estudios de carcinogenicidad en animales que emplearon dosis de vonoprazan considerablemente altas (de 5 mg/kg en ratas a 6 mg/kg en ratones) durante dos años, resultando en una mayor incidencia de tumores endocrinos gástricos en roedores.19 Dado que se conoce la predisposición de los roedores a desarrollar este tipo de tumores con la supresión ácida ya sea por antagonistas de los H2R o IBP, la interpretación de estos resultados debe hacerse con precaución, especialmente la alteración en la microbiota debido al uso a largo plazo de vonoprazan o de cualquier P-CAB, resultado de la disminución de la protección que brinda el ácido gástrico.14
1.1 Vonoprazan en ERGE
Desde su disponibilidad en el mercado, se han realizado múltiples ensayos clínicos que han demostrado que vonoprazan es superior a los IBP en el manejo de la ERGE erosiva severa (grados D y C de la clasificación de Los Ángeles), y similar en su eficacia en el manejo de ERGE leve y la enfermedad no erosiva (NERD). En la Tabla 4 se resumen los estudios más relevantes al uso de vonoprazan en ERGE (Tabla 4).21-44 Recientemente Fass y col. reportaron el primer estudio que demuestra la eficacia de vonoprazan como terapia a demanda, demostrando que se puede obtener alivio de la pirosis dentro de las 3 horas y sostenido por 24 horas con este esquema.41
Tabla 4. Estudios que han utilizado vonoprazan en el tratamiento de ERGE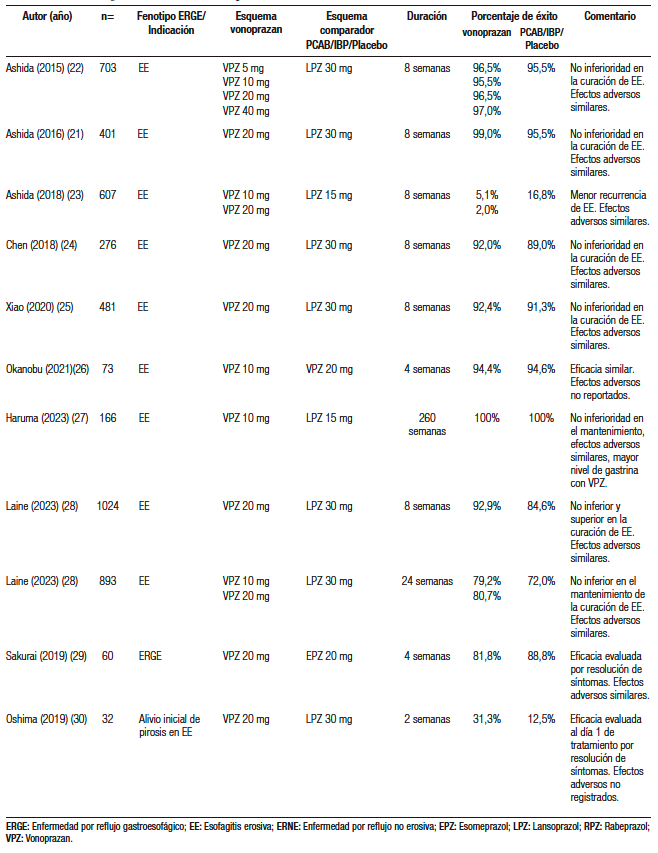
Tabla 4. Estudios que han utilizado vonoprazan en el tratamiento de ERGE
(continuación)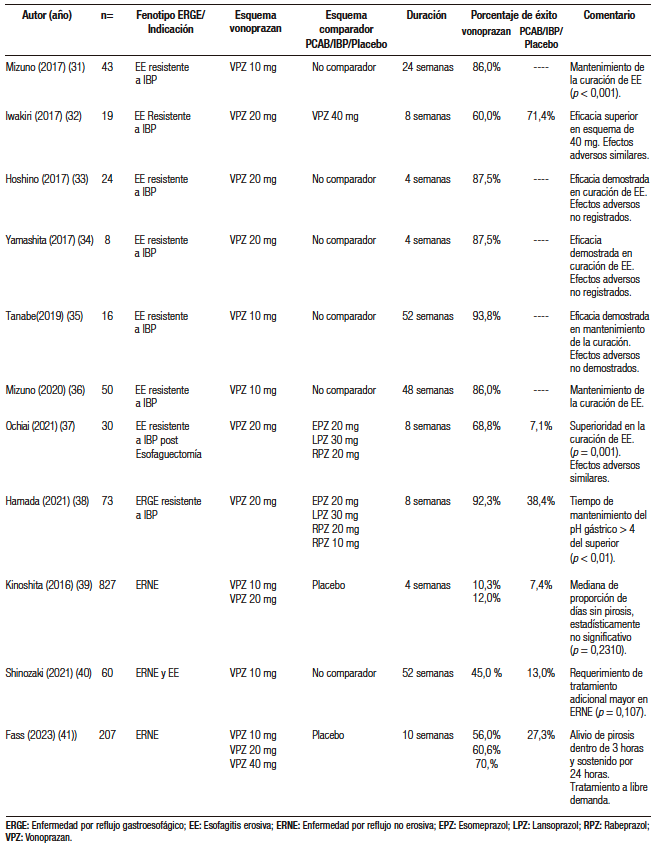
Tabla 4. Estudios que han utilizado vonoprazan en el tratamiento de ERGE
(continuación)
1.2 Vonoprazan para erradicar H. pylori
Considerando las propiedades farmacocinéticas de los P-CABs, recientemente se ha propuesto que el uso de estos fármacos puede mantener más rápido y de forma más potente el pH intragástrico por arriba de 6, favoreciendo así la erradicación de H. pylori. Así pues, ya existen regímenes descritos en la literatura (principalmente en Asia) que incorporan P-CABs.
Murakami y col. llevaron a cabo un estudio comparativo, aleatorizado, doble ciego y multicéntrico, para comparar la tasa de erradicación de H. pylori utilizando vonoprazan frente a los IBP en pacientes con úlceras gastroduodenales.45 En este estudio, el grupo tratado con vonoprazan 20 mg, amoxicilina 750 mg y claritromicina 200 mg o 400 mg, dos veces al día durante 7 días, alcanzó una tasa de erradicación del 92,6% IC del 95%, (89,2%-95,2%), mientras que el grupo tratado con lansoprazol 30 mg, amoxicilina 750 mg y claritromicina 200 mg o 400 mg, dos veces al día durante 7 días, obtuvo una tasa del 75,9% (95% IC, 70,9%-80,5%). Esto demostró la no inferioridad del tratamiento comparado con lansoprazol en el efecto terapéutico sobre la erradicación de H. pylori. Casi todos los estudios indicaron que la tasa de erradicación con vonoprazan superaba la obtenida con los IBPs.45,46 Wiliam y col. realizaron un ensayo controlado aleatorizado de fase 3 en los Estados Unidos y Europa, con 1046 pacientes sin tratamiento previo con infección por H. pylori. Fueron asignados aleatoriamente en proporción 1:1:1 a terapia dual de vonoprazan (20 mg de vonoprazan dos veces al día; 1 g de amoxicilina tres veces al día) o terapia triple en doble ciego dos veces al día (vonoprazan 20 mg o lansoprazol 30 mg; 1 g de amoxicilina; 500 mg de claritromicina) durante 14 días. En todos los pacientes, las terapias triple y dual con vonoprazan fueron superiores a la terapia triple con lansoprazol (80,8% y 77,2%, respectivamente, frente a 68,5%, diferencia 12,3%; 95% IC, 5,7-18,8; p < 001; diferencia 8,7%; 95% IC, 1,9-15,4; p = 013).47 En un análisis sistemático llevado a cabo por Jung y col., que incluyó a 10.644 pacientes distribuidos en diez estudios, se observó que la tasa de erradicación de H. pylori mediante análisis de intención de tratar alcanzó el 88,1% (IC del 95%, 86,1%-89,9%) en aquellos sometidos a terapia triple con vonoprazan, frente a un 72,8% (IC del 95%, 71,0%-75,4%) en los tratados con terapia triple basada en IBPs, evidenciando una superioridad de vonoprazan sobre los IBP (razón de riesgo combinada [IC del 95% = 1,19 (1,15-1,24)].48 Adicionalmente, Dong y colaboradores efectuaron un metaanálisis de catorce estudios con 14.636 pacientes, hallando que la relación de posibilidades de éxito en la erradicación con vonoprazan comparado con los IBP fue de 2,44 (IC del 95%, 1,99-2,99).49
Tegoprazan, anteriormente conocido como CJ-12420 y desarrollado por RaQualia Pharma junto con CJ HealthCare, marca un avance significativo en la categoría de medicamentos bloqueadores ácidos competitivos de potasio (P-CAB).50 Este compuesto, un derivado del benzimidazol, se caracteriza por su potente y rápida acción antisecretora. Actúa inhibiendo de manera reversible la bomba de protones mediante una interacción competitiva con el sitio de unión al potasio en la enzima, eliminando la necesidad de una activación previa por ácido.51 Este mecanismo permite al fármaco bloquear tanto las formas activas como inactivas de la bomba de protones, lo que resulta en una inhibición inmediata y sostenida de la secreción de ácido gástrico, ofreciendo así un alivio eficaz y duradero.52,53
Tegoprazan ha demostrado tener perfiles farmacocinéticos lineales, con efectos farmacodinámicos que varían según la dosis administrada, abarcando un espectro de 50 a 400 mg.7,10,54 En estudios realizados en adultos sanos, las dosis de tegoprazan de 50, 100, 200 o 400 mg alcanzaron la concentración máxima en plasma aproximadamente a la hora, con variaciones entre 0,5 y 1,5 horas, y presentaron una vida media de eliminación de entre 3,65 y 5,39 horas.10,11 El metabolismo principal del fármaco ocurre en el hígado, con una excreción urinaria mínima.54 Este medicamento se metaboliza principalmente a través de CYP3A4 hasta convertirse en su metabolito M1 (tegoprazan desmetilado).11,53-55 Debido a esto, existe la posibilidad de interacciones con fármacos que suprimen este sistema enzimático. Un caso representativo en estudios in vitro es el ketoconazol, un potente inhibidor del CYP3A4, el cual ha mostrado reducir de manera notable el metabolismo del tegoprazan en experimentos con microsomas hepáticos humanos. Sin embargo, se ha reportado que otros inhibidores del CYP no tienen un impacto significativo en la depuración metabólica del tegoprazan. La evidencia disponible indica que la exposición sistémica al tegoprazan se incrementa al ser administrado junto con claritromicina, un conocido inhibidor del CYP3A4. Esto implica que la administración simultánea de tegoprazan y determinados inhibidores del CYP3A4 podría necesitar una revisión en la dosificación o una vigilancia más rigurosa para evitar posibles reacciones adversas o una disminución en la efectividad del tratamiento.54
La solubilidad del fármaco es de 0,7 mg/mL a un pH de 3, pero disminuye a 0,02 mg/mL a un pH de 6,8. Basándose en simulaciones hechas con ChemAxon, se estima que la solubilidad de tegoprazan podría incrementarse hasta 223 mg/mL en un entorno de pH 1. Esto sugiere que la alimentación, variaciones en el pH gástrico y las dosis repetidas del medicamento pueden influir notablemente en cómo se distribuye y actúa tegoprazan en el organismo.53 A diferencia de los IBP tradicionales, tegoprazan ofrece una vida media prolongada y capacidad de unión reversible, lo que se traduce en una inhibición más efectiva de la secreción ácida nocturna.53 Adicionalmente, se ha reportado que la depuración aparente y el volumen de distribución de tegoprazan son de aproximadamente 17,6 L/h y 107,9 L, respectivamente.54
No se han reportado efectos adversos graves en los estudios de administración múltiple de tegoprazan.1 Mediante un análisis de cohortes realizado con datos de gran escala que abarcó a cincuenta millones de personas en Corea, se determinó que el tegoprazan no provocó un incremento en la hepatotoxicidad comparado con los IBPs. El riesgo relativo asociado al uso de tegoprazan en comparación con el dexlansoprazol, esomeprazol, lansoprazol, omeprazol, pantoprazol y rabeprazol fue de 0,73, con un intervalo de confianza del 95% de 0,72 a 0,75.56
2.1. Tegoprazan en ERGE
En el caso de tegoprazan se han descrito varios estudios al respecto, los cuales se mencionan a continuación. Shin y col.57 llevaron a cabo un estudio para evaluar si tegoprazan era no inferior a lansoprazol en el tratamiento de pacientes con EE. En ese estudio participaron 218 pacientes coreanos con EE confirmada endoscópicamente, quienes fueron asignados aleatoriamente a recibir tegoprazan 50 mg o lansoprazol 30 mg durante 2 o 4 semanas. Los resultados mostraron que las tasas de curación acumuladas a la semana 4 para tegoprazan 50 mg y lansoprazol 30 mg fueron del 94,2% (98/104) y 86,2% (94/109), respectivamente, con un IC del 95% para la diferencia de 0,12-15,86, y un valor de p < 0,00001 en la prueba de puntuación de no inferioridad. Además, las tasas de curación a la semana 2 fueron del 87,5% (91/104) para tegoprazan y del 82,6% (90/109) para lansoprazol, con un IC del 95% para la diferencia de -4,61 a 14,48, y un valor de p < 0,0011. Esto demostró la no inferioridad de tegoprazan 50 mg con lansoprazol 30 mg en el tratamiento de la EE. Por otra parte, Lee y col.58 observaron tasas de curación similares a las 8 semanas, con un 98,9% tanto para dosis de 50 mg como de 100 mg de tegoprazan, y esomeprazol de 40 mg. En el caso de la terapia de mantenimiento para EE leve (grado A y B), tegoprazan es comparable con las dosis estándares de IBP (como lansoprazol), pero es superior en el caso del mantenimiento de las EE más graves (C-D).59
Kim J y col.60 realizaron un estudio en el que, además de la remisión endoscópica, evaluaron los síntomas nocturnos y trastornos del sueño. Los pacientes fueron asignados aleatoriamente para recibir tegoprazan 50 mg o esomeprazol 40 mg durante 2 semanas. El enfoque principal de su estudio fue determinar el tiempo hasta alcanzar el primer intervalo sin acidez nocturna, y se comparó además el porcentaje de días sin acidez nocturna entre ambos grupos. En el estudio se observó que el intervalo hasta la primera noche sin acidez fue más breve en el grupo tratado con tegoprazan, en comparación con el grupo de esomeprazol, aunque la diferencia no alcanzó significancia estadística (1,5 días vs. 3 días, p = 0,151). De manera similar, el porcentaje de noches sin acidez fue mayor en el grupo tratado con tegoprazan (57,8% vs. 43,1%, p = 0,107).61 Estos resultados son similares a los reportados en un estudio previo realizado por Han y col.61 en el que evaluaron la farmacodinámica del tegoprazan en comparación con el dexlansoprazol, en lo que respecta al control del ácido nocturno en sujetos sanos. En este estudio se administró tegoprazan en dosis de 50, 100 o 200 mg, o dexlansoprazol de 60 mg. Los autores reportaron que todos los grupos tratados con tegoprazan alcanzaron un pH medio ≥ 4 en un lapso de 2 horas, en contraste con el grupo de dexlansoprazol, que tardó 7 horas posadministración para alcanzar el mismo nivel de pH. En otro estudio en voluntarios sanos, también se demostró que tegoprazan produce una supresión del ácido nocturno más rápida, potente y bien sostenida en comparación con vonoprazan o esomeprazol, cuando se administró por la noche con un porcentaje de tiempo a pH ≥ 4: 66,0% para tegoprazan vs. 60,5% para vonoprazan, p = 0.30 y 66,0% para tegoprazan vs. 36,1% para esomeprazol, p < 0.0001.62
Con respecto a la variante no-erosiva de la ERGE, el fenotipo más difícil de tratar, en un estudio realizado por Kim y col.63 en el que se compararon 50 mg o 100 mg de tegoprazan contra placebo durante 4 semanas, se demostró que el 42,5% (45/106), el 48,5% (48/99) y el 24,2% (24/99) de los pacientes mostraron una resolución completa de los síntomas, respectivamente. Ambas dosis de tegoprazan mostraron una eficacia superior que el placebo (p = 0,0058 y p = 0,0004, respectivamente). Las tasas de resolución completa de la pirosis y las proporciones de días sin acidez (como otros resultados de eficacia) fueron significativamente mayores en ambos grupos de tegoprazan que en el grupo de placebo.
2.2 Tegoprazan para erradicar H. pylori
Desde su disponibilidad en el mercado y hasta la fecha, se han realizado ocho ensayos clínicos controlados, utilizando diversos regímenes, que incluyen tegoprazan para erradicar H. pylori (Tabla 5).64-71 En resumen, se ha demostrado que, en regímenes de 7, 10 o 14 días, los esquemas que incluyen tegoprazan no son inferiores (e incluso llegan a ser superiores) cuando se compara con IBP como lansoprazol o rabeprazol.64-71 Se demuestra también que los eventos adversos son similares y que los esquemas cuádruples o concomitantes tiene tasas de erradicación muy aceptables, que son superiores al 85%.
Tabla 5. Estudios que han utilizado tegoprazan en el esquema de erradicación de
Helicobacter pylori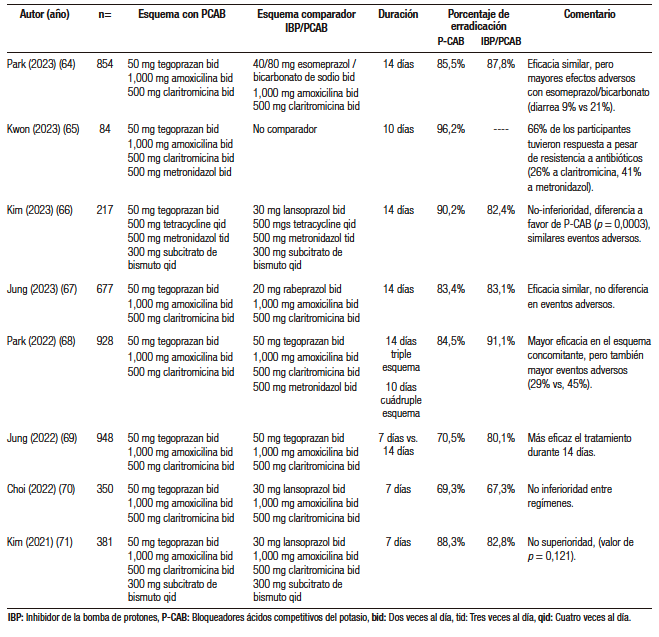
3. Fexuprazan
Fexuprazan, anteriormente conocido como DWP 14012, es un derivado de primidina desarrollado por Daewoong. Este fármaco es administrado vía oral y se elimina principalmente a través de vías no renales. Su metabolismo está liderado por la enzima CYP3A4, que no es polimórfica, y en menor medida por CYP2B6, CYP2D6 y CYP2C19.72,73 Tras su administración, la concentración máxima en plasma se alcanza entre 1,5-5 horas y posee una vida media plasmática de aproximadamente 9 horas. Su excreción urinaria es mínima, entre el 1% y el 3%, lo que evidencia su eliminación primordialmente no renal. Es importante señalar que la concentración plasmática de fexuprazan no se ve afectada significativamente por una dieta alta en grasas, en comparación con su toma en ayunas, y no se observó una acumulación relevante del medicamento tras administrar fexuprazan diariamente durante 7 días.74,75
Las reacciones adversas más frecuentes en los estudios que se han realizado incluyeron mareos, náuseas, dispepsia, dolor abdominal, diarrea y prurito.76,77 Fexuprazan 40 mg ha demostrado la no inferioridad a esomeprazol 40 mg en la curación de esofagitis erosiva en la semana 8 en distintos ensayos clínicos.76,78 Jung Jin Oh y col. evaluaron la actividad inhibidora de la agregación plaquetaria y la exposición sistémica a la aspirina en coadministración con fexuprazan, y reportaron que la exposición sistémica de fexuprazan disminuyó hasta un 20% por la coadministración de aspirina, concluyendo que no hay interacciones farmacodinámicas o farmacocinéticas clínicamente relevantes entre la aspirina y fexuprazan. Este hallazgo sugiere el potencial de fexuprazan para la prevención de complicaciones gastrointestinales inducidas por aspirina, sirviendo de base para optimizar su aplicación terapéutica con aspirina.79
3.1. Fexuprazan en ERGE
Al ser el más reciente P-CAB, la evidencia para sus indicaciones clínicas empieza a reportarse. Un estudio multicéntrico, doble ciego, aleatorizado de fase III, comparó 40 mg de fexuprazan o 40 mg de esomeprazol una vez al día durante 4 a 8 semanas en pacientes con EE.80 De un total de 332 sujetos, las tasas de curación de los grupos de fexuprazan y esomeprazol a las 8 semanas fueron del 88,5 % (146/165) y 89,0% (145/163). No se encontraron diferencias significativas entre los grupos en las tasas de curación de EE a las 4 semanas, las respuestas a los síntomas y los cambios en GERD-HRQL. La incidencia de EA relacionados con el fármaco fue del 19,4 % (32/165) en el grupo de fexuprazan y del 19,6% (32/163) en el grupo de esomeprazol. Así, pues, este estudio demostró una eficacia no inferior de fexuprazan a esomeprazol en el tratamiento de EE. Resultados similares habían sido reportados por Lee y col en Korea,81 en un ensayo en el que demostraron que fexuprazan no fue inferior a esomeprazol con respecto a la tasa de curación en la semana 8 (99,1% [106/107] frente a 99,1% [110/111]) en pacientes con EE. No hubo diferencias entre los grupos en la tasa de curación de EE en la semana 4 (90,3 % [93/103] frente a 88,5 % [92/104]), respuestas a los síntomas y evaluaciones de calidad. vida. Además, los niveles séricos de gastrina en las semanas 4 y 8 y los efectos secundarios relacionados con el fármaco no difirieron significativamente entre los grupos.
3.2. Fexuprazan en H. pylori
Hasta el momento no hay estudios que demuestren el uso de fexuprazan en el tratamiento para la erradicación de H. pylori. Sin embargo, fexuprazan ha demostrado ser más efectivo que el placebo en el tratamiento de gastritis agudas o crónicas que presentaban una o más erosiones gástricas en la endoscopía, con una mejoría a las dos semanas del 57,8% (59/102), 65,7% (67/102) y 40,6% (39/96) tras recibir fexuprazan 20 mg, fexuprazan 10 mg y placebo, respectivamente.82
4. Revaprazan
Revaprazan, previamente conocido como YH1885, es un fármaco desarrollado por YUHAN Pharmaceutical, derivado de la pirimidina. De igual forma que los demás P-CABs, actúa inhibiendo de manera reversible la bomba de protones mediante una interacción competitiva con el sitio de unión al potasio en la enzima, cuenta con una concentración máxima en plasma de 2.1 ± 1 h y una vida media en plasma de 2.4 ± 0.2 h.83,84 Sin embargo, la evidencia sobre la efectividad de la supresión acida del fármaco no ha mostrado ser similar a la del resto de los P-CABs. En un estudio comparativo, tras administrar una dosis única, el porcentaje de tiempo con un pH superior o igual a 4 fue mayor en el caso de tegoprazan que en el de revaprazan (54,5% frente a 25,1%). Después de administrar varias dosis, el porcentaje de tiempo con un pH > 4 continuó siendo mayor para tegoprazan en comparación con revaprazan (68,2% frente a 25,3%). Además, durante un período de 12 horas nocturnas, el porcentaje de tiempo con un pH superior o igual a 4 para tegoprazan superó al de revaprazan (71,8% frente a 31,9%).85
Debido a la limitada capacidad de lograr una supresión ácida eficaz, se han llevado a cabo diversos estudios con reformulaciones y cambios en el vehículo de administración del fármaco.86,87 Sin embargo, estas alternativas solo han demostrado evidencia en la farmacocinética del fármaco in vitro, pero no en la farmacodinámica. Por esta razón y porque no han demostrado evidencia de mejora en la supresión ácida, los autores de este trabajo consideramos que esto ha desalentado la realización de investigaciones adicionales con este medicamento.
5. Keverprazan
Keverprazan, anteriormente conocido como carenoprazan, representa una innovación en los P-CABs. Este fármaco ha sido desarrollado por Jiangsu Carephar Pharmaceutical y se basa en la estructura de vonoprazan, aprovechando un estudio detallado de sus relaciones estructura-actividad para optimizar su eficacia y perfil farmacocinético. Se caracteriza por una rápida absorción, alcanzando su concentración máxima en plasma (Tmax) a las 1,5 horas tras su administración. Su vida media de eliminación varía entre 6,23 y 6,75 horas cuando se administra a una dosis de 20 mg, y su principal metabolito identificado es el M9. Keverprazan ha demostrado ser altamente efectivo en la supresión de la acidez gástrica. Evaluado mediante el porcentaje de tiempo en que el pH gástrico se mantiene superior a 5 durante las primeras 24 horas tras la administración, las dosis de 20 mg y 40 mg de keverprazan alcanzaron porcentajes de 84,4% y 84,5%, respectivamente; y a los 7 días después de la administración continuada del medicamento, mostraron una mejora notable, con tasas de 97,4% para la dosis de 20 mg y 100,0% para la dosis de 40 mg.88,89
Keverprazan ha demostrado no inferioridad respecto de lansoprazol en la curación de úlceras duodenales. Los resultados a las 4 semanas mostraron que keverprazan 20 mg alcanzó una tasa de curación del 86,8% (144/166), mientras que lansoprazol 30 mg obtuvo una tasa del 85,6% (143/167). A las 6 semanas, las tasas de curación aumentaron a 98,2% (163/166) para keverprazan y a 97,6% (163/167) para lansoprazol.90 En un ensayo clínico previo realizado por Tan y col. se evaluó la eficacia en la curación de úlceras duodenales, demostrando que las tasas de curación a las 4 semanas fueron del 87,27% para keverprazan 20 mg, 90,16% para keverprazan 30 mg, y 79,69% para lansoprazol 30 mg. A las 6 semanas, los resultados fueron aún más favorables, con tasas del 96,36%, 98,36% y 92,19%, respectivamente.91
Chen y col. llevaron a cabo un estudio multicéntrico, doble ciego, aleatorizado y de fase III, para evaluar la eficacia de keverprazan en comparación con lansoprazol en la curación de la EE. En este estudio, los pacientes fueron aleatorizados para recibir 20 mg de keverprazan o 30 mg de lansoprazol, ambos administrados una vez al día durante un período de tratamiento que varió entre 4 y 8 semanas. De un total de 221 pacientes, las tasas de curación de EO a las 8 semanas fueron del 99,1% (110/111 pacientes) para el grupo tratado con keverprazan, en comparación con el 92,7% (102/110) para el grupo tratado con lansoprazol. La no inferioridad de keverprazan frente a lansoprazol fue demostrada con diferencias estadísticamente significativas (6,1% [IC 95%: 1,1%-11,2%], p = 0,018). No se reportaron eventos adversos graves con el uso de keverprazan.92 Estos estudios ofrecen una base sólida como evidencia del uso de keverprazan en la curación de úlceras duodenales y de esofagitis erosiva, mostrando tasas de curación superiores a lansoprazol, especialmente a dosis más altas.
6. Zastaprazan
Zastaprazan también conocido como JP-1366 C es un nuevo P-CAB desarrollado por Jeil Pharmaceutical. Recientemente, Hwang y col. evaluaron la eficacia de zastaprazan en sujetos sanos. El estudio cuantificó la supresión del ácido gástrico mediante el porcentaje de tiempo en que el pH gástrico se mantenía > 4. Los resultados revelaron que zastaprazan mostraba una mejora dosis-dependiente en la supresión ácida: las dosis de 20 mg y 40 mg alcanzaron porcentajes de 85,19% y 91,84%, respectivamente. Estos resultados fueron significativamente superiores al esomeprazol 40 mg, el cual solo alcanzó un 72,06%. Con base en los resultados del fenotipado de reacción in vitro de zastaprazan utilizando isoformas de CYP recombinantes humanas, se ha sugerido que CYP3A4 y CYP3A5 son las principales enzimas metabólicas de este fármaco. Zastaprazan se absorbe en 2 horas y se elimina con una vida media de 6 a 10 horas. El perfil de seguridad y tolerabilidad de zastaprazan también fue evaluado, demostrando ser bien tolerado, sin cambios clínicamente significativos en las evaluaciones realizadas.93 Este fármaco muestra un gran potencial como una nueva opción terapéutica dentro de este grupo farmacológico, empero es crucial la realización de más ensayos clínicos que evalúen su efectividad y seguridad en las distintas enfermedades relacionadas al ácido.
Los P-CABs, incluidos vonoprazan, fexuprazan, tegoprazan, revaprazan, keverprazan y zastaprazan ofrecen una estrategia terapéutica avanzada para tratar trastornos gastrointestinales relacionados con el ácido. Al inhibir de manera reversible y competitiva la bomba de protones H+/K+-ATPasa, estos medicamentos han mostrado no inferioridad y, en ocasiones, superioridad en eficacia y rapidez en relación con los IBP tradicionales. Podrían considerarse alternativas prometedoras para el manejo de enfermedades ácido-dependientes.
Propiedad intelectual. Los autores declaran que los datos, las tablas y las figuras presentes en el manuscrito son originales y se realizaron en sus instituciones pertenecientes.
Financiamiento. Los autores declaran que no hubo fuentes de financiación externas.
Conflicto de interés. Los autores declaran no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor

© 2024 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Remes-Troche J M, Vargas-Basurto J L y Valdovinos-García L. Impacto de los P-Cabs en el tratamiento de las enfermedades relacionadas con el ácido: una revisión de la evidencia. Acta Gastroenterol Latinoam. 2024;54(2):119-138. https://doi.org/10.52787/agl.v54i2.414
Referencias
Correspondencia:
José M. Remes-Troche
Correo electrónico: jose.remes.troche@gmail.com
Acta Gastroenterol Latinoam 2024;54(2):119-138