Evaluaciones pre y post reprocesamiento manual y automatizado de endoscopios: aislamiento microbiológico
DOI:
https://doi.org/10.52787/agl.v54i3.423Palabras clave:
Endoscopios, reprocesamiento, contaminaciónResumen
Introducción. El endoscopio es un tubo flexible con cámara y luz, usado para diagnosticar y tratar patologías digestivas. Aunque las infecciones asociadas al cuidado de la salud son raras, representan un serio problema. El reprocesamiento adecuado del endoscopio es esencial para prevenir infecciones, por lo que deben seguirse guías que incluyan lineamientos de limpieza, desinfección y almacenamiento.
Objetivo. Comparar la eficacia del reprocesamiento manual y automatizado en videogastroscopios y videocolonoscopios mediante la vigilancia microbiológica de los siguientes microrganismos: Escherichia coli BLEE, Shigella spp., Salmonella spp., Pseudomonas aeruginosa, Klebsiella pneumoniae productora de carbapenemasa de tipo KPC y Enterococcus spp. vancomicina resistente.
Materiales y métodos. Se realizó un estudio prospectivo, observacional y descriptivo en el que se seleccionaron 207 procedimientos de reprocesamiento de videogastroscopios y videocolonoscopios (103 manuales y 104 automatizados) y se evaluaron durante las etapas de pre y post reprocesamiento. Se cultivaron con propósito de aislar Escherichia coli beta lactamasa de espectro extendido, Shigella spp., Salmonella spp., Pseudomonas aeruginosa, Klebsiella pneumoniae productora de carbapenemasa y Enterococcus spp. vancomicina resistente.
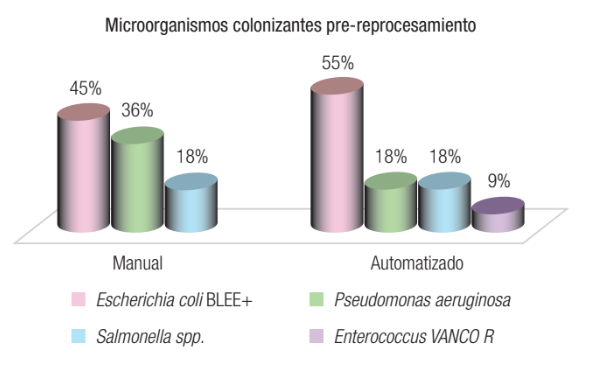
Resultados. En muestras pre reprocesamiento manual y automatizado se aislaron Escherichia coli BLEE (45% vs. 55%); Pseudomonas aeruginosa (36% vs. 18%); Salmonella spp. (18% en ambas) y 9% Enterococcus spp. vancomicina resistentes en el automatizado. Los resultados post reprocesamiento manuales arrojaron en el 1% recuentos de 1000 - 99.999 UFC/ml y en el 6% más de 100.000 UFC/ml. El automatizado refirió 7% más de 100.000 UFC/ml. Al comparar ambas modalidades, en 7/103 de las muestras manuales no se hallaron los patógenos investigados, al igual que en 6/104 de las muestras automatizadas. Solo se observó desarrollo de Staphylococcus coagulasa negativa, posible contaminante. No obstante, en una muestra automatizada se aisló Salmonella spp.
Conclusión. Los resultados fueron similares con ambas metodologías. Se obtuvo desarrollo de un enteropatógeno en el reprocesamiento automatizado. Estos hallazgos permitirán replantear mejoras en los pasos del reprocesamiento, con la finalidad de mejorar los procedimientos.
Citas
-1. Blázquez-Garrido RM, Cuchí-Burgos E, Martín-Salas C, Ruiz-Garbajosa P. Métodos microbiológicos para la monitorización de la limpieza, desinfección y esterilización de dispositivos médicos. Enferm Infecc Microbiol Clin [Internet]. 2018;36(10):657-61. Disponible en: http://dx.doi.org/10.1016/j.eimc.2017.09.012
-2. Juan H. Programa Nacional de Vigilancia de Infecciones Hospitalarias de Argentina (VIHDA). Áreas Críticas y Cirugía Programa Nacional. 2019;2020.
-3. Kovaleva J, Peters FT, Van Der Mei HC, Degener JE. Transmission of infection by flexible gastrointestinal endoscopy and bronchoscopy. Clinical Microbiology Reviews. 2013;26(2):231-54.
-4. Nelson DB. Infectious disease complications of Gl endoscopy: Part I, endogenous infections. Gastrointestinal Endoscopy. 2003;57(4):546-56.
-5. Lascano VM. Control de calidad microbiológico en la desinfección de colonoscopios, gastroscopios y broncoscopios. Trabajo Integrador Final (Especialista en Esterilización). Facultad de Ciencias Químicas. 2015.
-6. Robles C, Turín C, Villar A, Huerta-Mercado J, Samalvides F. Evaluación microbiológica de la desinfección de alto nivel de los endoscopios flexibles en un hospital general. Revista de Gastroenterología del Perú. 2014;34(2): 115-9:
-7. Rutala WA, Weber DJ. Guideline for Disinfection and Sterilization in Healthcare Facilities. North Carolina: CDC. 2008;158.
-8. Speer T. Actualización de la desinfección de endoscopios: guía para un reprocesamiento sensible a los recursos. WGO/WEO Global Guideline Endoscope Disinfection. World Gastroenterology Organisation. 2019.
-9. Diana Weinstock, Nadia Poczter, Lucía Daciuk y Analía Martínez. Consenso entre las siguientes Sociedades Científicas: Endoscopistas Digestivos de Buenos Aires-Sociedad Argentina de Infectología - Club Argentino de Esterilización. Guía de reprocesamiento de endoscopios y material accesorios [Internet]. 2014. Disponible en: http://www.endiba.org.ar/site/index.php/recursos/guias.
-10. Beilenhoff U, Neumann CS, Rey JF, Biering H, Blum R, Schmidt V, & null and the ESGE Guidelines Committee. ESGE-ESGENA guideline for quality assurance in reprocessing: microbiological surveillance testing in endoscopy. Endoscopy. 2007;39(02):175-81.
-11. Graziano KU, Pereira MEA, Koda E. Propuesta metodológica para la validación de la eficacia de la desinfección de un reprocesador automatizado de endoscopios flexibles. Revista Latino-Americana de Enfermagem. 2016.
-12. Sosa-Hernández Ó, Campos-Jiménez R. Relevancia del reprocesamiento de los endoscopios en el control de infecciones. Endoscopia [Internet]. 2019;31(4). Disponible en: http://dx.doi.org/10.24875/end.19000023.
-13. Shin SP, Kim WH. Recent update on microbiological monitoring of gastrointestinal endoscopes after High-Level disinfection. Clin Endosc [Internet]. 2015;48(5):369-73. Disponible en: http://dx.doi.org/10.5946/ce.2015.48.5.369.
-14. Manual sobre el método de endoscopía. Instrucciones de utilización asociadas con el sistema [Internet]. Disponible en: https:www.olympusoste.eu/media/contact_and_support/download/system_guides/W7052_803.pdf.
-15. Petersen BT, Chennat J, Cohen J, Cotton PB, Greenwald DA, Kowalski TE, et al. Multisociety guideline on reprocessing flexible GI endoscopes: 2011. Infect Control Hosp Epidemiol [Internet]. 2011;32(6):527-37. Disponible en: http://dx.doi.org/10.1086/660676.
-16. Spaulding EH, Groschel DH. Hospital disinfectants and antiseptics. Manual of clinical microbiology. Washington DC: American Society for Microbiology. 1974. Pp. 852-7.
-17. Argaraña Gerico A, Enriqueta H-S. Recomendaciones AEEED Limpieza y desinfección en endoscopía gastrointestinal. www.aeeed.com; 2013.
-18. Bradley CR, Babb JR. Endoscope decontamination: automated vs. manual. J Hosp Infect [Internet]. 1995;30Suppl:537-42. Disponible en: http://dx.doi.org/10.1016/0195-6701(95)90060-8 .
-19. Pérez DN, González IB, Pastor VP, Mateu PN, Bellver VO, Felis TS. y Viudez L A, editor. Comparación de la eficacia en la limpieza y desinfección de videoendoscopios: mecanizada frente a manual. 2000 23(9): 412-5.
-20. Alfa MJ, Olson N, DeGagne P. Automated washing with the Reliance Endoscope Processing System and its equivalence to optimal manual cleaning. Am J Infect Control [Internet]. 2006;34(9):561-70. Disponible en: http://dx.doi.org/10.1016/j.ajic.2006.01.010.
-21. Kaczmarek RG, Moore RM Jr, McCrohan J, Goldmann DA, Reynolds C, Caquelin C, et al. Multi-state investigation of the actual disinfection/sterilization of endoscopes in health care facilities. Am J Med [Internet]. 1992;92(3):257-61. Disponible en: http://dx.doi.org/10.1016/0002-9343(92)90074-l.
-22. Acosta-Gnass SI. Manual de esterilización para centros de salud. Pan American Health Org. 2008.
Bader L, Blumenstock G, Birkner B, Leiss O, Heesemann J, Riemann JF, et al. HYGEA (Hygiene in gastroenterology-endoscope reprocessing): Study on quality of reprocessing flexible endoscopes in hospitals and in the practice setting. Zeitschrift fur Gastroenterologie. 2002;40(3):157-70.
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2024 Romina Medeot, Javier Mena, Pablo Rodríguez, Pablo Herrera Najum, Luis López, María Soledad Muñoz

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-CompartirIgual 4.0.












